降血糖糖、改善β细胞功能和胰岛素抵抗,糖尿病治疗迎来新的曙光
转自《国际糖尿病》_本文原题:从机制到临床 , GLP-1RA引领糖尿病管理新变革
编者按:随着人类对糖尿病疾病的不断认识 , 临床治疗的需求不断演变 。 从胰岛素的发现 , 到T2DM核心缺陷的研究——胰岛β细胞功能减退和胰岛素抵抗 , 再到血糖水平、降糖药物与糖尿病远期并发症的相关性探讨 , T2DM治疗的理念不断完善 。 同时具有降糖、改善β细胞功能和胰岛素抵抗 , 并能够改善远期并发症的药物是临床治疗的需求所在 。 GLP-1受体激动剂(GLP-1RA)等新型降糖药物应运而生 。 随着其降糖疗效的公布、降糖外获益的不断发现 , 糖尿病治疗迎来新的曙光 。 在刚刚结束的中华医学会糖尿病学分会(CDS)年会中 , 一系列GLP-1RA的主题多角度呈现 , 从作用机制的探讨到重磅研究的回顾 , 再到未来更强效、获益更多的新药介绍 , 从不同方面展示了以利拉鲁肽、司美格鲁肽等为代表的GLP-1RA在糖尿病管理中不断满足治疗需求的循证证据及权威指南推荐 。 本文汇总如下 , 供各位临床医生参考 。
T2DM核心发病机制研究历程--tt-darkmode-bgcolor: #131313;">
在本届CDS年会中郑州大学第一附属医院的秦贵军教授带来的演讲从2020 ADA 班廷大奖谈起 。 意大利比萨大学的Ferrannini 教授多年来致力于胰岛素抵抗和β细胞的研究 , 其重大发现包括:T2DM患者的β细胞功能逐渐下降 , 葡萄糖敏感性降低 , 与血糖值呈显著负相关[1-2];胰岛素抵抗是连续的过程 , 胰岛素抵抗与T2DM发生发展密切相关[2] 。 而有研究显示胰岛素敏感性是T2DM患者发生心血管疾病(CVD)事件的独立预测因素[3] 。 因此 , 秦教授指出 , T2DM治疗应从发病机制入手 , 尽早改善糖尿病患者的β细胞功能、提高β细胞对葡萄糖的敏感性 , 改善胰岛素抵抗 。 肠促胰素类药物GLP-1RA可显著提高早期T2DM患者胰岛素分泌敏感性指数-2(ISIS-2) , 显著提高β细胞对葡萄糖的敏感性[4-5] 。 其中利拉鲁肽的大型临床系列研究LEAD研究荟萃分析显示其可明显改善β细胞功能 , 提高胰岛β细胞功能指数 , 改善胰岛素原:胰岛素比值[6](图1) 。 LEAD3研究表明利拉鲁肽可以显著降低胰岛素抵抗指数(HOMA-IR) , 增加胰岛素敏感性[7] 。
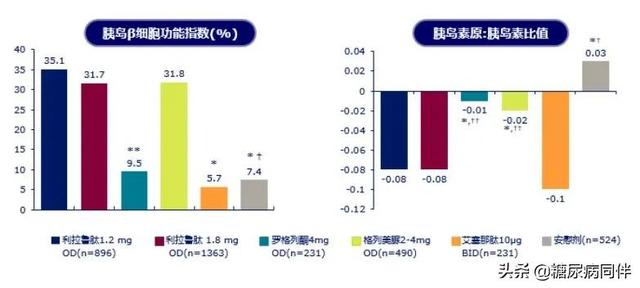 文章插图
文章插图
图1. 利拉鲁肽可明显改善β细胞功能
T2DM达标障碍之临床惰性 & GLP-1RA早期起始、长期达标优势
治疗惰性是指T2DM患者未能在适当的时机起始或强化治疗 , 是血糖控制不佳、心血管事件和死亡风险增加的主要原因[8] 。 来自复旦大学华山医院的李益明教授在CDS年会中指出 , 最新的ADA指南关注治疗惰性 , 强调了早期联合、起始强化治疗的重要性 。 为避免治疗惰性 , 指南建议定期评估、及时调整治疗方案 , 并建议多方协作 , 医生严格遵循糖尿病指南推荐进行规范管理 。
基于GLP-1RA的多重获益 , 各大指南均对其进行了积极推荐 , 无论合并动脉粥样硬化性心血管疾病、心衰或者慢性肾脏疾病的患者、迫切需要降低低血糖风险的患者或是迫切需要减少体重增加或具有减重需求的患者推荐可尽早启动GLP-1RA治疗 。
那么按照指南启用利拉鲁肽是否具有临床价值?在2020年ADA年会中 , 一项针对基层医疗机构进行的开放标签、活性对照、随机分组的LIRA-PRIME研究对近2000例T2DM患者进行了为期两年的观察显示 , 二甲双胍控制不佳的患者与继续口服降糖药物(OAD)治疗相比 , 启用利拉鲁肽治疗显著降低血糖控制不佳的风险(HR: 0.58 , 95%CI: 0.51-0.66 , P<0.0001)) , 患者出现血糖控制不佳(HbA1c> 7.0%)的时间晚于OAD治疗组 , 中位发生时间延迟44周;且利拉鲁肽组的HbA1c达标(HbA1c≤6.5%)及复合终点达标(HbA1c≤7.0%且无重度或BG确认的症状性低血糖和体重增加)的比例均较OAD组高[9](图2) 。 另外一项真实世界的研究也显示相比应用不足1年的患者 , 利拉鲁肽起始治疗并坚持应用1年以上者能更好地控制代谢指标 , 包括HbA1c、体重及BMI[10] 。 此两项研究充分显示了早期起始、长期应用利拉鲁肽的优势所在 。
推荐阅读
- 糖尿病的五个表现,你了解吗?若能早点掌握,或许可以稳住血糖值
- 血糖偏高时,脚上可能出现这三种现象,你或许还没注意到
- 打破传统治疗标准!拉罗替尼挑战转移性非小细胞肺癌的一线治疗
- 发现有口臭?可能是消化道出问题了,送你3个好办法,有效改善
- 最简血糖值记忆法345678、7111、9111
- 这4种家常菜,多吃血糖或许会“飙升”,糖友们要记住,尽量少碰
- 八宝丹,国家保密配方,改善乙肝患者症状、肝功能指标,消退黄疸
- 细胞|国内首个!浦东企业开启肿瘤免疫治疗新征程
- 千古“降痰”第一方!上清肺痰,下补阳气,改善痰多咳嗽
- 全球首次确认!母亲生产时宫颈癌细胞通过羊水转移致婴儿肺癌



![[坦言]收入提高了?滴滴司机坦言:因为平台这波操作,现在收入](/renwen/images/defaultpic.gif)













