йӘЁй«“еўһз”ҹејӮеёёз»јеҗҲеҫҒдёӯеӣҪиҜҠж–ӯдёҺжІ»з–—жҢҮеҚ—пјҲ2019е№ҙзүҲпјү( еӣӣ )
 ж–Үз« жҸ’еӣҫ
ж–Үз« жҸ’еӣҫ
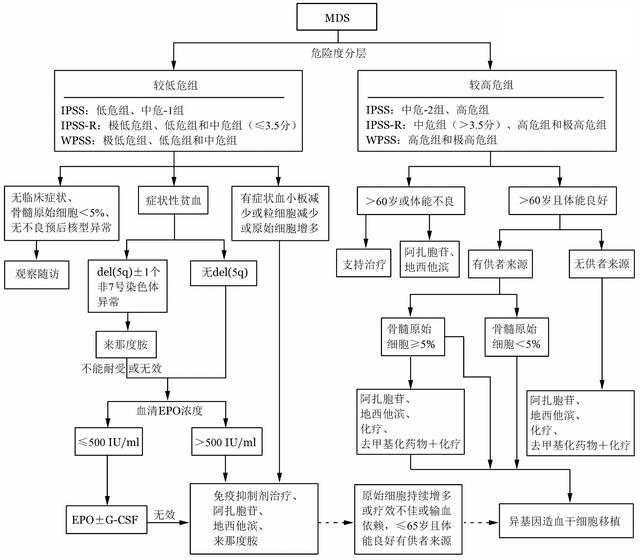
еӣҫ1 йӘЁй«“еўһз”ҹејӮеёёз»јеҗҲеҫҒпјҲMDSпјүзҡ„жІ»з–—и·Ҝеҫ„
пјҲдёҖпјүж”ҜжҢҒжІ»з–—
ж”ҜжҢҒжІ»з–—жңҖдё»иҰҒзӣ®ж ҮдёәжҸҗеҚҮжӮЈиҖ…з”ҹжҙ»иҙЁйҮҸ гҖӮ еҢ…жӢ¬жҲҗеҲҶиҫ“иЎҖгҖҒEPOгҖҒG-CSFжҲ–GM-CSFе’ҢеҺ»й“ҒжІ»з–— гҖӮ
1пјҺжҲҗеҲҶиҫ“иЎҖпјҡ
дёҖиҲ¬еңЁHGB<60 g/LжҲ–дјҙжңүжҳҺжҳҫиҙ«иЎҖз—ҮзҠ¶ж—¶еҸҜз»ҷдәҲзәўз»Ҷиғһиҫ“жіЁ гҖӮ жӮЈиҖ…дёәиҖҒе№ҙгҖҒжңәдҪ“д»ЈеҒҝиғҪеҠӣеҸ—йҷҗгҖҒйңҖж°§йҮҸеўһеҠ ж—¶ пјҢ е»әи®®HGBвүӨ80 g/Lж—¶з»ҷдәҲзәўз»Ҷиғһиҫ“жіЁ гҖӮ PLT<10Г—109/LжҲ–жңүжҙ»еҠЁжҖ§еҮәиЎҖж—¶ пјҢ еә”з»ҷдәҲиЎҖе°Ҹжқҝиҫ“жіЁ гҖӮ
2пјҺйҖ иЎҖз”ҹй•ҝеӣ еӯҗпјҡ
G-CSF/GM-CSF пјҢ жҺЁиҚҗз”ЁдәҺдёӯжҖ§зІ’з»Ҷиғһзјәд№Ҹдё”дјҙжңүеҸҚеӨҚжҲ–жҢҒз»ӯжҖ§ж„ҹжҹ“зҡ„MDSжӮЈиҖ… гҖӮ иҫ“иЎҖдҫқиө–зҡ„иҫғдҪҺеҚұз»„MDSжӮЈиҖ…еҸҜйҮҮз”ЁEPOВұG-CSFжІ»з–— пјҢ жІ»з–—еүҚEPOж°ҙе№і<500 IU/mlе’Ңзәўз»Ҷиғһиҫ“жіЁдҫқиө–иҫғиҪ»пјҲжҜҸжңҲ<8 Uпјүзҡ„MDSжӮЈиҖ…EPOжІ»з–—еҸҚеә”зҺҮжӣҙй«ҳ гҖӮ
3пјҺеҺ»й“ҒжІ»з–—пјҡ
еҜ№дәҺзәўз»Ҷиғһиҫ“жіЁдҫқиө–зҡ„жӮЈиҖ…еә”е®ҡжңҹзӣ‘жөӢиЎҖжё…й“ҒиӣӢзҷҪпјҲSFпјүж°ҙе№ігҖҒзҙҜи®Ўиҫ“иЎҖйҮҸе’ҢеҷЁе®ҳеҠҹиғҪзӣ‘жөӢпјҲеҝғгҖҒиӮқгҖҒиғ°и…әпјү пјҢ иҜ„д»·й“ҒиҝҮиҪҪзЁӢеәҰпјҲжңүжқЎд»¶зҡ„еҚ•дҪҚеҸҜйҮҮз”ЁMRIиҜ„дј°еҝғи„Ҹе’ҢиӮқи„Ҹзҡ„й“ҒжІүз§ҜзЁӢеәҰпјү гҖӮ еҺ»й“ҒжІ»з–—еҸҜжңүж•ҲйҷҚдҪҺSFж°ҙе№іеҸҠи„ҸеҷЁдёӯзҡ„й“Ғеҗ«йҮҸ гҖӮ еҜ№дәҺйў„жңҹеҜҝе‘ҪвүҘ1е№ҙгҖҒжҖ»йҮҸи¶…иҝҮ80 UгҖҒSFвүҘ1 000 Ојg/LиҮіе°‘2дёӘжңҲгҖҒиҫ“иЎҖдҫқиө–зҡ„жӮЈиҖ… пјҢ еҸҜе®һж–ҪеҺ»й“ҒжІ»з–— пјҢ 并д»ҘSFдёәдё»иҰҒзӣ‘жөӢеҸҠжҺ§еҲ¶жҢҮж ҮпјҲзӣ®ж ҮжҳҜе°ҶSFжҺ§еҲ¶еңЁ500~1 000 Ојg/Lпјү гҖӮ еёёз”Ёзҡ„еҺ»й“ҒиҚҜзү©жңүеҺ»й“Ғиғәе’Ңең°жӢүзҪ—еҸёзӯү гҖӮ
пјҲдәҢпјүе…Қз–«и°ғиҠӮеүӮжІ»з–—
еёёз”Ёзҡ„е…Қз–«и°ғиҠӮиҚҜзү©еҢ…жӢ¬жІҷеҲ©еәҰиғәе’ҢжқҘйӮЈеәҰиғәзӯү гҖӮ йғЁеҲҶжӮЈиҖ…жҺҘеҸ—жІҷеҲ©еәҰиғәжІ»з–—еҗҺеҸҜж”№е–„зәўзі»йҖ иЎҖ пјҢ еҮҸиҪ»жҲ–и„ұзҰ»иҫ“иЎҖдҫқиө– пјҢ 然иҖҢжӮЈиҖ…еёёйҡҫд»ҘиҖҗеҸ—й•ҝжңҹеә”з”ЁеҗҺеҮәзҺ°зҡ„зҘһз»ҸжҜ’жҖ§зӯүдёҚиүҜеҸҚеә” гҖӮ еҜ№дәҺдјҙжңүdelпјҲ5qпјүВұ1з§Қе…¶д»–ејӮеёёпјҲйҷӨ-7/7q-еӨ–пјүзҡ„иҫғдҪҺеҚұз»„MDSжӮЈиҖ… пјҢ еҰӮеӯҳеңЁиҫ“иЎҖдҫқиө–жҖ§иҙ«иЎҖ пјҢ еҸҜеә”з”ЁжқҘйӮЈеәҰиғәжІ»з–— пјҢ йғЁеҲҶжӮЈиҖ…еҸҜеҮҸиҪ»жҲ–и„ұзҰ»иҫ“иЎҖдҫқиө– пјҢ 并иҺ·еҫ—з»ҶиғһйҒ—дј еӯҰзј“и§Ј пјҢ 延й•ҝз”ҹеӯҳ гҖӮ еҜ№дәҺдёҚдјҙжңүdelпјҲ5qпјүзҡ„иҫғдҪҺеҚұз»„MDSжӮЈиҖ… пјҢ еҰӮеӯҳеңЁиҫ“иЎҖдҫқиө–жҖ§иҙ«иЎҖгҖҒдё”еҜ№з»Ҷиғһеӣ еӯҗжІ»з–—ж•ҲжһңдёҚдҪіжҲ–дёҚйҖӮеҗҲйҮҮз”Ёз»Ҷиғһеӣ еӯҗжІ»з–— пјҢ д№ҹеҸҜд»ҘйҖүжӢ©жқҘйӮЈеәҰиғәжІ»з–— гҖӮ жқҘйӮЈеәҰиғәзҡ„еёёз”ЁеүӮйҮҸ10 mg/dГ—21 d пјҢ жҜҸ28 dдёә1дёӘз–—зЁӢ гҖӮ дјҙжңүdelпјҲ5qпјүзҡ„MDSжӮЈиҖ… пјҢ еҰӮеҮәзҺ°дёӢеҲ—жғ…еҶөдёҚе»әи®®еә”з”ЁжқҘйӮЈеәҰиғәпјҡв‘ йӘЁй«“еҺҹе§Ӣз»ҶиғһжҜ”дҫӢ>5%пјӣв‘ЎеӨҚжқӮжҹ“иүІдҪ“ж ёеһӢпјӣв‘ўIPSS-дёӯеҚұ-2жҲ–й«ҳеҚұз»„пјӣв‘ЈTP53еҹәеӣ зӘҒеҸҳ гҖӮ
пјҲдёүпјүе…Қз–«жҠ‘еҲ¶еүӮжІ»з–—
е…Қз–«жҠ‘еҲ¶жІ»з–—пјҲISTпјүеҢ…жӢ¬жҠ—иғёи…әз»ҶиғһзҗғиӣӢзҷҪпјҲATGпјүе’ҢзҺҜеӯўзҙ A пјҢ еҸҜиҖғиҷ‘з”ЁдәҺе…·еӨҮдёӢеҲ—жқЎд»¶зҡ„жӮЈиҖ…пјҡйў„еҗҺеҲҶз»„дёәиҫғдҪҺеҚұгҖҒйӘЁй«“еҺҹе§Ӣз»ҶиғһжҜ”дҫӢ<5%жҲ–йӘЁй«“еўһз”ҹдҪҺдёӢгҖҒжӯЈеёёж ёеһӢжҲ–еҚ•зәҜ+8гҖҒеӯҳеңЁиҫ“иЎҖдҫқиө–гҖҒHLA-DR15йҳіжҖ§жҲ–еӯҳеңЁPNHе…ӢйҡҶ гҖӮ
пјҲеӣӣпјүеҺ»з”ІеҹәеҢ–иҚҜзү©
еёёз”Ёзҡ„еҺ»з”ІеҹәеҢ–иҚҜзү©еҢ…жӢ¬5-йҳҝжүҺиғһиӢ·пјҲazacitidine пјҢ AZAпјүе’Ң5-йҳҝжүҺ-2-и„ұж°§иғһиӢ·пјҲdecitabine пјҢ ең°иҘҝд»–ж»Ёпјү гҖӮ еҺ»з”ІеҹәеҢ–иҚҜзү©еҸҜеә”з”ЁдәҺиҫғй«ҳеҚұз»„MDSжӮЈиҖ… пјҢ дёҺж”ҜжҢҒжІ»з–—з»„зӣёжҜ” пјҢ еҺ»з”ІеҹәеҢ–иҚҜзү©жІ»з–—з»„еҸҜйҷҚдҪҺжӮЈиҖ…еҗ‘AMLиҝӣеұ•зҡ„йЈҺйҷ©гҖҒж”№е–„з”ҹеӯҳ гҖӮ иҫғдҪҺеҚұз»„MDSжӮЈиҖ…еҰӮеҮәзҺ°дёҘйҮҚзІ’з»ҶиғһеҮҸе°‘е’ҢпјҲжҲ–пјүиЎҖе°ҸжқҝеҮҸе°‘ пјҢ д№ҹеҸҜеә”з”ЁеҺ»з”ІеҹәеҢ–иҚҜзү©жІ»з–— пјҢ д»Ҙж”№е–„иЎҖз»ҶиғһеҮҸе°‘ гҖӮ
1пјҺAZAпјҡ
жҺЁиҚҗз”Ёжі•дёә75 mgВ·m-2В·d-1Г—7 d пјҢ зҡ®дёӢжіЁе°„ пјҢ 28 dдёә1дёӘз–—зЁӢ гҖӮ жҺҘеҸ—AZAжІ»з–—зҡ„MDSжӮЈиҖ… пјҢ йҰ–ж¬ЎиҺ·еҫ—жІ»з–—еҸҚеә”зҡ„дёӯдҪҚж—¶й—ҙдёә3дёӘз–—зЁӢ пјҢ зәҰ90%жІ»з–—жңүж•Ҳзҡ„жӮЈиҖ…еңЁ6дёӘз–—зЁӢеҶ…иҺ·еҫ—жІ»з–—еҸҚеә” гҖӮ еӣ жӯӨ пјҢ жҺЁиҚҗMDSжӮЈиҖ…жҺҘеҸ—AZAжІ»з–—6дёӘз–—зЁӢеҗҺиҜ„д»·жІ»з–—еҸҚеә” пјҢ жңүж•ҲжӮЈиҖ…еҸҜжҢҒз»ӯдҪҝз”Ё гҖӮ
2пјҺең°иҘҝд»–ж»Ёпјҡ
ең°иҘҝд»–ж»Ёзҡ„жңҖдҪіз»ҷиҚҜж–№жЎҲд»ҚеңЁдёҚж–ӯжҺўзҙўдёӯ пјҢ иҫғдҪҺеҚұз»„MDSжӮЈиҖ…ең°иҘҝд»–ж»ЁжңҖдҪіз»ҷиҚҜж–№жЎҲиҝ„д»Ҡе°ҡжңӘиҫҫжҲҗе…ұиҜҶ гҖӮ жҺЁиҚҗж–№жЎҲд№ӢдёҖдёә20 mgВ·m-2В·d-1Г—5 d пјҢ жҜҸ4е‘Ёдёә1дёӘз–—зЁӢ гҖӮ жҺЁиҚҗMDSжӮЈиҖ…жҺҘеҸ—ең°иҘҝд»–ж»ЁжІ»з–—4~6дёӘз–—зЁӢеҗҺиҜ„д»·жІ»з–—еҸҚеә” пјҢ жңүж•ҲжӮЈиҖ…еҸҜжҢҒз»ӯдҪҝз”Ё гҖӮ
пјҲдә”пјүеҢ–з–—
иҫғй«ҳеҚұз»„е°Өе…¶жҳҜеҺҹе§Ӣз»ҶиғһжҜ”дҫӢеўһй«ҳзҡ„жӮЈиҖ…йў„еҗҺиҫғе·® пјҢ еҢ–з–—жҳҜйҖүжӢ©йқһйҖ иЎҖе№Із»Ҷиғһ移жӨҚпјҲHSCTпјүжӮЈиҖ…зҡ„жІ»з–—ж–№ејҸд№ӢдёҖ гҖӮ еҸҜйҮҮеҸ–AMLж ҮеҮҶ3+7иҜұеҜјж–№жЎҲжҲ–йў„жҝҖж–№жЎҲ гҖӮ йў„жҝҖж–№жЎҲеңЁеӣҪеҶ…е№ҝжіӣеә”з”ЁдәҺиҫғй«ҳеҚұMDSжӮЈиҖ… пјҢ дёәе°ҸеүӮйҮҸйҳҝзі–иғһиӢ·пјҲ10 mg/m2 пјҢ жҜҸ12 h 1ж¬Ў пјҢ зҡ®дёӢжіЁе°„ пјҢ Г—14 dпјүеҹәзЎҖдёҠеҠ з”ЁG-CSF пјҢ 并иҒ”еҗҲйҳҝе…ӢжӢүйңүзҙ жҲ–й«ҳдёүе°–жқүй…ҜзўұжҲ–еҺ»з”Іж°§жҹ”зәўйңүзҙ гҖӮ йў„жҝҖж–№жЎҲжІ»з–—иҫғй«ҳеҚұMDSжӮЈиҖ…зҡ„е®Ңе…Ёзј“и§ЈзҺҮеҸҜиҫҫ40%~60% пјҢ дё”иҖҒе№ҙжҲ–иә«дҪ“жңәиғҪиҫғе·®зҡ„жӮЈиҖ…еҜ№йў„жҝҖж–№жЎҲзҡ„иҖҗеҸ—жҖ§дјҳдәҺ常规AMLеҢ–з–—ж–№жЎҲ гҖӮ йў„жҝҖж–№жЎҲд№ҹеҸҜдёҺеҺ»з”ІеҹәеҢ–иҚҜзү©иҒ”еҗҲ гҖӮ
жҺЁиҚҗйҳ…иҜ»
- е°ҝй…ёи¶…ж Үзҡ„дәәпјҢжҷҡдёҠзқЎи§үиә«дҪ“жҲ–и®ёдјҡеҮәзҺ°иҝҷ3ејӮеёёпјҢдёҚеҰЁдәҶи§ЈеҘҪйҷҚй…ё
- иӮқеҠҹиғҪејӮеёёзҡ„дәәпјҢеҳҙе·ҙжңүж—¶дјҡеҮәзҺ°4дёӘејӮеёёпјҢиҝҷз§Қж°ҙжһңе»әи®®дҪ еҲ«еҗғ
- йӘЁй«“зӮҺзҡ„жІ»з–—йҮҚзӮ№еңЁе“ӘйҮҢпјҹ
- ејӮеёё|еҝҪи§ҶиҝҷдёӘжҢҮж ҮпјҢеҝғи„ҸеҮәй—®йўҳдәҶйғҪдёҚзҹҘйҒ“пјҒжҠ“дҪҸ3дёӘдҝЎеҸ·пјҢиҝңзҰ»еҝғжў—
- е°ҝж¶ІжҳҜиӮҫи„Ҹзҡ„вҖңжҷҙйӣЁиЎЁвҖқпјҢиӢҘжңү3дёӘејӮеёёзҺ°иұЎпјҢе°ұиҰҒеј•иө·иӯҰжғ•дәҶ
- еҰӮдҪ•еҫ—зҹҘиЎҖз®ЎеҘҪдёҚеҘҪпјҹиӢҘе°Ҹи…ҝжІЎжңүиҝҷ3дёӘејӮеёёиЎЁзҺ°пјҢеҖјеҫ—жҒӯе–ң
- иӮқз—…жқҘдёҙдёҚз—ӣдёҚз—’пјҹзҡ®иӮӨжңү4з§ҚејӮеёёпјҢжҲ–жҳҜиӮқе·ІвҖңжүӣдёҚдҪҸвҖқпјҢеҲ«еҝҪи§Ҷ
- дҪ“жЈҖеҸ‘зҺ°иӮқеҠҹејӮеёёжҖҺд№ҲеҠһпјҹ
- е°ҝй…ёй«ҳдёҚй«ҳпјҢзңӢе°ҸдҫҝиғҪзҹҘжҷ“еӨ§жҰӮпјҒдёүз§ҚејӮеёёпјҢзңҹеёҢжңӣдҪ дёҖдёӘдёҚеҚ
- е°ҝж¶ІеҮәзҺ°ејӮеёёпјҢжҲ–жҳҜиә«дҪ“ејҖе§ӢеҝҚдёҚдҪҸдәҶпјҢеҮ дёӘй—®йўҳеҗ‘дҪ жұҮжҠҘ














