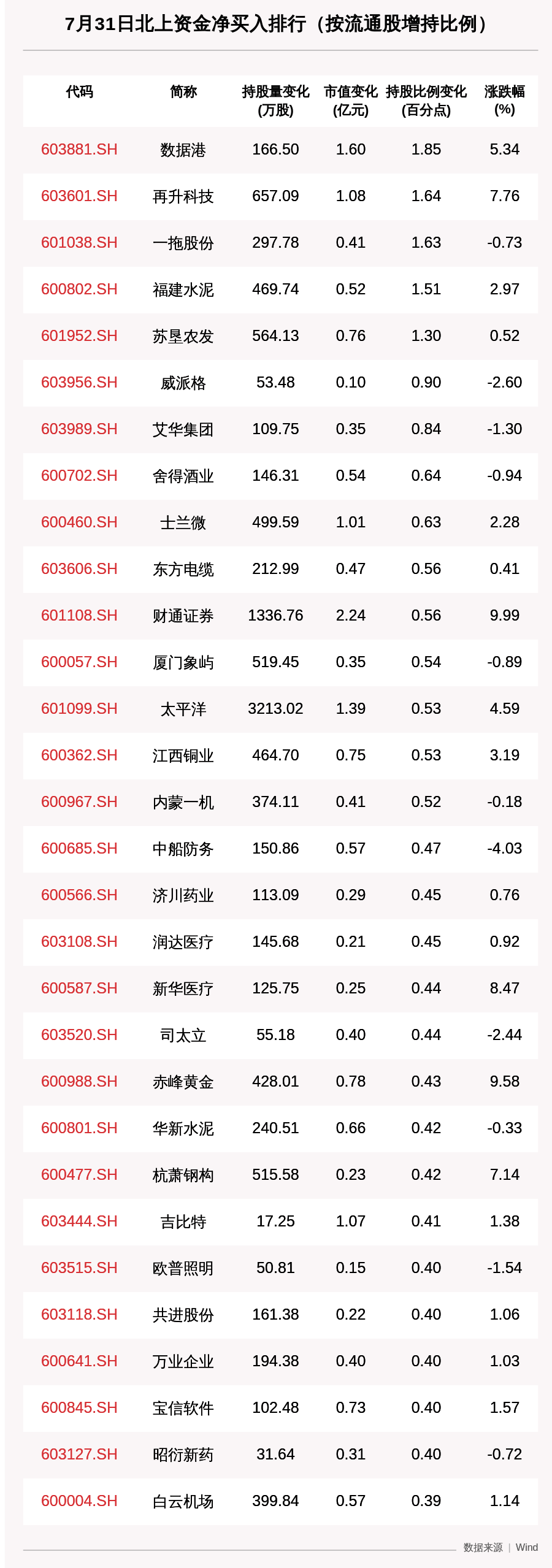
з”ҹзү©жҺўзҙў|PNASпјҡвҖңеӨңзҢ«еӯҗвҖқзқЎзң йҡңзўҚз«ҹ然дјҡжҳҜеҹәеӣ зӘҒеҸҳеҜјиҮҙзҡ„пјҒ
дәәзұ»з”ҹзҗҶе’ҢиЎҢдёәзҡ„жҳјеӨңиҠӮеҫӢжҳҜз”ұз»Ҷиғһдёӯж—¶й’ҹиӣӢзҷҪзҡ„е‘ЁжңҹжҖ§зӣёдә’дҪңз”ЁиҖҢй©ұеҠЁзҡ„ гҖӮ еҪ“ж—¶й’ҹиӣӢзҷҪеҮәзҺ°зӘҒеҸҳж—¶ пјҢ жҳјеӨңиҠӮеҫӢеҸҜиғҪе°ұдјҡеӨұи°ғ пјҢ жңүзҡ„дәәеҫҖеҫҖдјҡжҜ”е№іж—¶жӣҙж—©е…ҘзқЎе’Ңиө·еәҠ пјҢ жңүзҡ„дәәеҲҷдјҡжҲҗдёәе…ёеһӢзҡ„еӨңзҢ«еӯҗ пјҢ йҖҡеёёиҰҒзҶ¬еӨңеҲ°2зӮ№д№ӢеҗҺжүҚиғҪе…ҘзқЎ пјҢ еҪ“然д№ҹйҡҫд»Ҙж—©иө· гҖӮ2017е№ҙжқҘиҮӘзҫҺеӣҪжҙӣе…ӢиҸІеӢ’еӨ§еӯҰзҡ„еӣўйҳҹеҸ‘зҺ°дәҶдёҖдёӘеҪұе“ҚдәәдҪ“ж—ҘеёёиҠӮеҘҸзҡ„з”ҹзү©й’ҹзҡ„е…ій”®жҲҗеҲҶзҡ„еҸҳдҪ“пјҡеҚізјәеӨұеӨ–жҳҫеӯҗ11зҡ„зј–з ҒйҡҗиҠұиүІзҙ зҡ„иӣӢзҷҪCRY1пјҲ CRY1О”11пјү пјҢ иҜҘиӣӢзҷҪзҡ„йҒ—дј еҸҳејӮеҜјиҮҙдәҶ延иҝҹе…ҘзқЎзҡ„иҝҹзқЎзң йҳ¶ж®өйҡңзўҚпјҲDSPDпјү гҖӮ дҪҶе…¶дёӯCRY1зҡ„зӘҒеҸҳжҳҜеҰӮдҪ•еҪұе“Қдәәзұ»жҳјеӨңиҠӮеҫӢзҡ„д»ҚжңӘеҸҜзҹҘ гҖӮиҝ‘ж—Ҙ пјҢ жқҘиҮӘзҫҺеӣҪеҠ еҲ©зҰҸе°јдәҡеӨ§еӯҰзҡ„з ”з©¶дәәе‘ҳеңЁгҖҠPNASгҖӢдёҠеҸ‘иЎЁдәҶйўҳдёәThe human CRY1 tail controls circadian timing by regulating its association with CLOCK:BMAL1зҡ„з ”з©¶жҲҗжһң пјҢ жҸӯзӨәдәҶз”ҹзү©й’ҹиӣӢзҷҪд№ӢдёҖCRY1зҡ„еӨ–жҳҫеӯҗ11зјәеӨұеј•еҸ‘延иҝҹзқЎзң зӣёйҡңзўҚзҡ„жңәеҲ¶ пјҢ еҚійҖҡиҝҮи°ғиҠӮCRY1дёҺCLOCKпјҡBMAL1зҡ„дә’дҪңзҙ§еҜҶзЁӢеәҰиҖҢж”№еҸҳдәҶжҳјеӨңиҠӮеҫӢ гҖӮгҖҗз”ҹзү©жҺўзҙў|PNASпјҡвҖңеӨңзҢ«еӯҗвҖқзқЎзң йҡңзўҚз«ҹ然дјҡжҳҜеҹәеӣ зӘҒеҸҳеҜјиҮҙзҡ„пјҒгҖ‘
жң¬ж–ҮжҸ’еӣҫ
https://doi.org/10.1073/pnas.1920653117 еүҚжңҹз ”з©¶еҸ‘зҺ° пјҢ жҺ§еҲ¶дәәдҪ“жҳјеӨңиҠӮеҫӢзҡ„ж—¶й’ҹиӣӢзҷҪдё»иҰҒжңү4з§Қ пјҢ ж—¶й’ҹиӣӢзҷҪCLOCKе’ҢBMAL1иғҪеӨҹеҪўжҲҗејӮдәҢиҒҡдҪ“иҪ¬еҪ•еӣ еӯҗ пјҢ дҝғиҝӣCRY1/2е’ҢPER1/2зҡ„иЎЁиҫҫ пјҢ иҖҢCRY1/2е’ҢPER1/2еҸҲиғҪеӨҹз»“еҗҲжҲҗеӨҚеҗҲзү©жқҘжҠ‘еҲ¶еүҚдёӨдёӘиӣӢзҷҪзҡ„жҙ»жҖ§ пјҢ з”ұжӯӨжһ„жҲҗдәҶдёҖдёӘи°ғжҺ§з”ҹзү©й’ҹзҡ„еҸҚйҰҲеӣһи·Ҝ гҖӮ иҖҢж”№еҸҳCRY1еҜ№BMAL1дёӯTADз»“жһ„еҹҹзҡ„дәІе’ҢеҠӣ пјҢ еҸҜд»ҘйҖҡиҝҮзј©зҹӯжҲ–延й•ҝеҸҚйҰҲеӣһи·ҜдёӯжҠ‘еҲ¶зҡ„жҢҒз»ӯж—¶й—ҙиҖҢж”№еҸҳжҳјеӨңиҠӮеҫӢ гҖӮдёәдәҶжҳҺзЎ®CRY1зҡ„еӨ–жҳҫеӯҗ11зҡ„зӘҒеҸҳжҳҜеҰӮдҪ•еҪұе“ҚжҳјеӨңиҠӮеҫӢзҡ„ пјҢ з ”з©¶дәәе‘ҳйҰ–е…ҲдҪҝз”ЁиҚ§е…үеҒҸжҢҜпјҲFPпјүеҜ№CRY1зҡ„е°ҫе·ҙдёҺеҸҚејҸPHRеҠҹиғҪеҹҹзҡ„з»“еҗҲиҝӣиЎҢдәҶеҲҶжһҗ пјҢ еҸ‘зҺ°CRY1е°ҫйғЁеҸҜд»ҘзӣҙжҺҘдёҺCRY1зҡ„PHRеҠҹиғҪеҹҹз»“еҗҲ пјҢ иҖҢеӨ–жҳҫеӯҗ11зјәеӨұеҗҺ пјҢ е…¶дёҺPHRзҡ„дәІе’ҢеҠӣдёӢйҷҚдәҶ4еҖҚ гҖӮ
жң¬ж–ҮжҸ’еӣҫ
CRY1е°ҫйғЁзҡ„еӨ–жҳҫеӯҗ10е’Ң11жҳҜPHRз»“еҗҲжүҖеҝ…йңҖзҡ„
жң¬ж–ҮжҸ’еӣҫ
ж ёзЈҒе…ұжҢҜжіўи°ұз»ҳеҲ¶дәҶCRY1е°ҫйғЁзҡ„PHRз»“еҗҲдҪҚзӮ№ CRY1 PHRдёҺCLOCK:BMAL1ејӮжәҗдәҢиҒҡдҪ“зҡ„з»“еҗҲжңүдёӨдёӘжҺҘеҸЈ пјҢ дёҖдёӘжҳҜCRY1зҡ„еҚ·жӣІиһәж—ӢдёҺBMAL1зҡ„TADпјҲеҸҚејҸжҝҖжҙ»еҠҹиғҪеҹҹпјүз»“еҗҲ пјҢ еҸҰдёҖдёӘжҳҜCRY1дёҺCLOCKзҡ„PAS-Bз»“еҗҲ гҖӮ еҹәдәҺеӨ–жҳҫеӯҗ11еңЁCRY1е°ҫе·ҙдёҺе…¶PHRз»“жһ„еҹҹдә’дҪңдёӯзҡ„йҮҚиҰҒдҪңз”Ё пјҢ з ”з©¶дәәе‘ҳдҪҝз”ЁиҚ§е…үж Үи®°зҡ„BMAL1 TADе’ҢCLOCK PAS-BиҝӣиЎҢдәҶеҹәдәҺFPзҡ„PHRз»“еҗҲеҠӣеҲҶжһҗ пјҢ еҸ‘зҺ°CRY1е°ҫйғЁеңЁи°ғиҠӮCRY1 PHRе’ҢBMAL1 TADдә’дҪңдёӯж— жҳҺжҳҫдҪңз”Ё пјҢ дҪҶе…¶еҸҜд»Ҙд»ҺPHRеҹҹдёӯзҪ®жҚўеҮәCLOCK PAS-B пјҢ дё”е…¶дёӯеӨ–жҳҫеӯҗ11еҜ№и°ғиҠӮCLOCK PAS-Bе’ҢCRY1 PHRз»“жһ„еҹҹд№Ӣй—ҙзҡ„дә’дҪңе…·жңүе…ій”®йҮҚиҰҒдҪңз”Ё гҖӮ
жң¬ж–ҮжҸ’еӣҫ
еӨ–жҳҫеӯҗ11дёҺCLOCK PAS-Bз«һдәү пјҢ йҷҚдҪҺCRY1дёҺCLOCKпјҡBMAL1зҡ„дәІе’ҢеҠӣ д№ӢеҗҺ пјҢ з ”з©¶дәәе‘ҳдҪҝз”Ёз”ҹзү©еұӮе№Іж¶үжңҜпјҲBLIпјүжқҘе®ҡйҮҸиҜ„дј°е…Ёй•ҝCRY1 пјҢ CRY1О”11е’Ңж— е°ҫCRY1 PHRеҹҹеҜ№CLOCKпјҡBMAL1зҡ„PASж ёеҝғеҹҹзҡ„дәІе’ҢеҠӣ пјҢ еҸ‘зҺ°дёҺе…Ёй•ҝCRY1зӣёжҜ” пјҢ CRY1О”11е’Ңж— е°ҫCRY1 PHRеҹҹдёҺе…¶е…·жңүжӣҙй«ҳзҡ„дәІе’ҢеҠӣ гҖӮ 并йҖҡиҝҮиҚ§е…үзҙ й…¶жҠҘе‘Ҡзі»з»ҹиҜҒжҳҺдәҶCRY1О”11еҜ№CLOCKзҡ„дәІе’ҢеҠӣеўһејәзӣҙжҺҘеўһејәдәҶе…¶жҠ‘еҲ¶CLOCKпјҡBMAL1иҪ¬еҪ•жҝҖжҙ»зҡ„иғҪеҠӣ гҖӮ з”ұжӯӨ пјҢ жӢүй•ҝдәҶи°ғжҺ§з”ҹзү©й’ҹзҡ„еҸҚйҰҲеӣһи·ҜдёӯжҠ‘еҲ¶зҡ„жҢҒз»ӯж—¶й—ҙ пјҢ иҝӣиҖҢж”№еҸҳдәҶжҳјеӨңиҠӮеҫӢ пјҢ еҜјиҮҙ延иҝҹе…ҘзқЎ гҖӮиҜҘз ”з©¶зҡ„йҖҡи®ҜдҪңиҖ…Carrie L. PartchиЎЁзӨәпјҡвҖңз ”з©¶з»“жһңиЎЁжҳҺCRY1дёҺCLOCKдә’дҪңзҡ„зҙ§еҜҶзЁӢеәҰеҶіе®ҡдәҶз”ҹзү©ж—¶й’ҹиҝҗиЎҢзҡ„йҖҹеәҰ пјҢ иҝҷд№ҹеңЁжҸҗзӨәжҲ‘们 пјҢ еә”иҜҘеҜ»жүҫиғҪеӨҹдёҺCLOCKпјҡBMAL1з»“еҗҲ并еҸҜд»Ҙиө·еҲ°дёҺCRY1е°ҫе·ҙзӣёеҗҢеҠҹиғҪзҡ„иҚҜзү© пјҢ ејҖеҸ‘еҮәеҸҜд»Ҙзј©зҹӯзқЎзң йҳ¶ж®өйҡңзўҚжӮЈиҖ…ж—¶й’ҹзҡ„з–—жі• гҖӮ вҖқEnd
еҸӮиҖғиө„ж–ҷпјҡ
жҺЁиҚҗйҳ…иҜ»
- й’“йұјеӨ§еҜ№еҶі|д»ҺеһӮй’“дәҶи§Јз”ҹзү©иҝӣеҢ–еҸІгҖҠй’“йұјеӨ§еҜ№еҶігҖӢд№ҰеҶҷйұјзұ»зҷҫ科全д№Ұ
- еҲҶжөҒ|5: 5еҲҶжөҒе…¶е®һ并дёҚеҸҜжҖ•пјҢж—©жңүдәәжҺўзҙўеҮәиҒҢж•ҷеҸ‘еұ•д№Ӣи·ҜпјҢеҸҜеҒҡеүҚиҪҰд№Ӣйүҙ
- ж№ҳжҪӯ|вҖңдёҖдәәдёҖжқҶвҖқеһӮ钓被没收渔具 й•ҝжұҹжөҒеҹҹж°ҙз”ҹз”ҹзү©дҝқжҠӨеҢәе…ЁйқўзҰҒжӯўеһӮй’“
- |еһғеңҫе…¬еҸёзҡ„дә”еӨ§зү№еҫҒпјҢе…·еӨҮдәҢжқЎд»ҘдёҠзҡ„зҒөиҜғз”ҹзү©еҠқдҪ жҸҗжЎ¶иө¶зҙ§и·‘еҗ§
- ipo|еҲӣе°”з”ҹзү©дёҠеёӮвҖңй—Ҝе…івҖқеӨұиҙҘпјҢвҖңеҢ»зҫҺйқўиҶңвҖқзҡ„иҙўеҜҢеҜҶз Ғд№ҹеӨұж•ҲдәҶпјҹ
- жһҒз®ҖйЈҺ|еҶ¬еӨ©д№ҹиҰҒеҒҡж°”иҙЁеҘідәәпјҢдёҖиө·жҺўзҙўвҖңж—Ҙзі»жһҒз®ҖйЈҺз©ҝжҗӯвҖқпјҢи¶ҠзңӢи¶ҠиҖҗзңӢ
- жө®жёёз”ҹзү©|иҜҶж°ҙиүІиҫЁйұјжғ…пјҢиғҪдёҚиғҪдёӢз«ҝй’“йұјпјҢеҲҶжё…жҘҡж°ҙиүІе°ұеҸҜд»ҘдәҶ
- е®үеҫҪзңҒжЈҖеҜҹйҷў|еҸҲдёҖз”ҹзү©иў«зҰҒжҚ•пјҢжҳҺжҳҺжҳҜвҖңе®іиҷ«вҖқдёәдҪ•иҰҒдҝқжҠӨпјҢиҝҷж¬Ўй’“йұјдәәиҰҒиғҢй”…
- иҒҢдёҡж•ҷиӮІ|жҷәиҒ”жӢӣиҒҳжү§иЎҢеүҜжҖ»иЈҒжқҺејәпјҡеҗҲеҗҢй”Ғе®ҡдёҚдәҶе№ҙиҪ»дәәпјҢйӣҮдё»йңҖжҺўзҙўиҝһжҺҘж–°жЁЎејҸ
- з§ӢжӢӣ|2021з§ӢжӢӣз»“жқҹпјҢеҚҠеҜјдҪ“иҪҜ件з”ҹзү©еҲ¶иҚҜеӨ§зҒ«пјҢжҲҝдә§ж•ҷеҹ№еҜ’еҶ¬зңҹжӯЈеҲ°жқҘ