最近一拥而上、多达200项的新冠病毒肺炎临床试验 , 让一些学者坐立难安 。 北京、上海、广州、南京、西安科研机构的多位卫生统计学与流行病学专家 , 对当下的新冠病毒肺炎的临床试验提出了批评和建议 。 他们的文章《关于科学、规范、有序地开展新型冠状病毒肺炎相关临床试验的建议》(以下简称 “建议”)近日发表在新一期的《中华流行病学杂志》上 。 本刊2月10日曾就此发表《 疫情吃紧 , 40余项临床试验一股脑上马为哪般?》 , 没想到 , 短短十几天 , 新冠肺炎的临床试验已经由几十项飙升到200项 。 一下子上如此多的临床 , 除了给前线救治增加负担外 , 一个基本的问题是 , 去哪找那么多合适的病人?如果病人样本量明显不够 , 又怎么能获得扎实可靠的结论?

遗憾的是 , 从几位专家的分析看 , 如果放任下去 , 新冠临床试验 “一地鸡毛” 的尴尬结局似乎不可避免 。
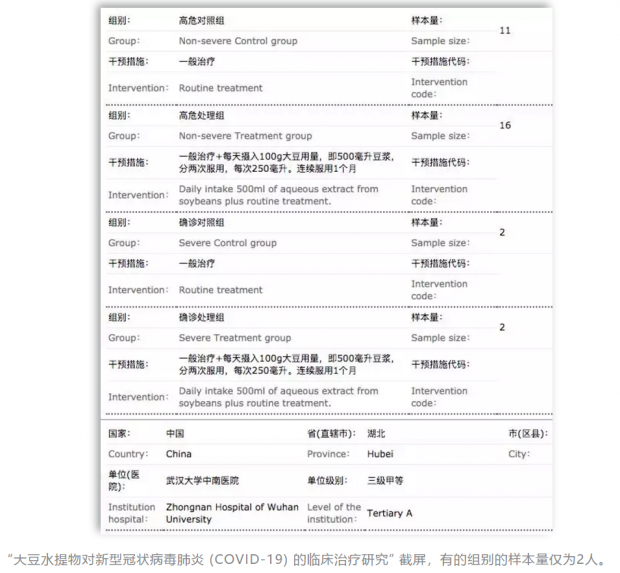
01 病人样本不足 , 结论不可靠 此番注册的临床试验 , 除了有限的诊断性和观察性研究外 , 大部分是治疗性的临床试验 , 达到了139项 。 那么 , 理论上开展这么多临床 , 需要多少病人呢? 几位作者分析指出 , 如果临床试验以轻症患者作为研究对象 , 治愈率提升5个百分点(从目前的90%提升至95%) , 则每项试验需要近1000例病患参与;如果考察重症转化率降低5%(目前湖北地区重症不超过20%) , 同样需要800~1000例患者参与 。 那么 , 如果研究重症患者的病死率 , 需要多少病人呢?几位作者指出 , “根据目前资料看 , 初诊为重症的患者病死率为6% , 如果试验药物能将病死率降低50% , 理论上则每项试验至少需要800例重症患者参与” 。 照此 , 以目前注册的139项计 , 保守算下来 , 假如每项要求800例患者参与 , 总的参与病人需要10万以上 。 可昨日(2月25日)的全国现存确诊人数 , 仅有4.7万多人 , 根本就不够用 。 事实上 , 专家发现 , 一些临床试验的 “样本量明显不够 , 可能因把握度不足而难以获得预期结论” 。 本刊查阅后发现 , 部分临床研究的样本量只有几十例 , 有的甚至才几例 。 而随着全国的疫情得到部分控制 , 确诊的人数正逐步下降 , 截止到2月25日下午5点 , 15个省地区直辖市的确诊病例不到50例 , 除了湖北、广东、浙江、山东 , 其余的确诊病例均在300例以下 。 照此推论 , 有的省恐怕一个临床试验都不够做 。 而从目前一些发表的临床研究看 , 因为样本量的不足 , 恐怕也很难得出什么确定性的结论 。 比如 , 天津中医药大学张伯礼等人最近发表了《中西医结合治疗新型冠状病毒肺炎34例临床研究》 , 对湖北省中西医结合医院出院的52例新型冠状病毒肺炎患者 , 分为中西医结合治疗组(34例)和西医组(18例)进行了研究 , 结论是中西医结合治疗新型冠状病毒肺炎能显著减轻患者的临床症状 。 此外 , 上海市公共卫生临床中心感染与免疫科的卢洪洲等人 , 最近也发表了“洛匹那韦利托那韦和阿比多尔用于治疗新型冠状病毒肺炎的有效性研究” , 对134例患者进行了分组研究 , 认为 “这项研究没有发现洛匹那韦/利托那韦和阿比多尔对缓解症状或加速病毒清除有任何作用 。 ” 苏州偶领生物医药有限公司总经理谢雨礼告诉《知识分子》 , “我个人对小样本临床试验的结果是存疑的 , 无论正反结果 。 对于正面结果 , 如果没有充分的证据链 , 包括临床前的研究 , 基本不太相信 。 ” 不仅是样本的问题 , 本刊查询后发现 , 不少的临床试验设计 , 也没有坚持随机、对照 , 很多没有使用盲法评价 。 前述研究者指出 , 临床试验如果没有高质量的设计 , “如样本量不足 , 对照组的选择不合理 , 分组的随机化与遮蔽执行不严格 , 疗效指标的评价标准不客观 , 加之数据的完整性、真实性保障不充分 , 那么这些临床研究就难以提供高质量的有效性和安全性证据 , 使得首试患者、研究者和管理部门的努力付诸东流 。 ” 02 不该上的临床也上 目前 , 多达200项的有关新冠肺炎的临床试验 , 涉及的药物和疗法五花八门 , 包括抗艾滋病的药物 , 治感冒、流感的药 , 干扰素、糖皮质激素 , 各种中药、中药注射剂、脐带血、干细胞等等 。 在一些病毒学家和药学家看来 , 显然并不是这些药都值得一试 。 “一般来说 , 如果有一种药物在体外试验中证明对冠状病毒有效 , 特别是对新型冠状病毒有效 , 在细胞层面上能抑制病毒的复制 , 或是在病毒感染的动物试验中证明有效 , 且该药物已经是上市的药 , 不管之前用来治其他疾病的 , 就有很充足的理由进入临床试验 。 ” 亚利桑那大学药学院助理教授王俊告诉《知识分子》 。 “既然是已经上市的药物 , 就证明安全性是有一定保障的 , 或者说有大量的临床数据可供参考 , 意味着这个药服多大剂量 , 服多长时间 , 它会带来什么样的副作用 , 这个是有据可依的 。 ” 王俊补充说道 。 此前 , 喧嚣一时的双黄连被爆出只是在1月29日晚到30日晨 , 由上海药物所做了一个简单的细胞水平的抗病毒活性测试 , 并未发表详细的试验研究数据 。 不过 , 这并不妨碍双黄连被用于新冠的临床试验研究 。 本刊在中国临床试验注册中心网站检索后发现 , 由华中科技大学同济医学院附属同济医院主持的400例确诊病人参与的 “双黄连口服液治疗新型冠状病毒肺炎(COVID-19)有效性和安全性的随机、开放、平行对照、多中心临床试验 ” 正在进行 , 在盲法部分写着“开放” , 意即所有各方包括病人自己都清楚吃的是什么 。 对于当前几十种中医药的临床试验(包括中药注射剂) , 美国德克萨斯州立大学圣安东尼奥医学中心教授项焰也对本刊表示 , “中医药成分不清 , 我个人觉得纯粹是浪费时间甚至有害无利 。 ” 值得注意的是 , 新冠肺炎的轻症患者本身有一定自愈性 , 较多用于这类患者的中医药究竟起了多大作用 , 也需要严格的试验证明 。 王俊向《知识分子》表示 , “中药我不做评论 , 就是说 , 我不清楚它的逻辑在哪里 , 依据在哪 。 其实另外一些药上临床的逻辑我也压根不明白 。 ” 他进一步解释道 , “因为我本身是研究流感的 , 我很清楚 , 从分子机理来讲 , 阿比多尔(arbidol)和奥司他韦(oseltamivir)所作用的病毒蛋白 , 只在流感病毒上存在 , 相同的蛋白在新型冠状病毒上是不存在的 。 就是说 , 从理论上讲 , 没有任何理由相信阿比多尔和奥司他韦能对新冠状病毒有效 , 并且到目前为止 , 没有任何公开发表的试验数据证明它们对新型冠状病毒还有非典病毒和中东呼吸综合症病毒的复制具有抑制作用 。 所以 , 我不清楚这里面的逻辑 , 为什么要用这些药物来作为候选药物进行新型冠状病毒的临床研究 。 ” 之前被媒体争相报道的李兰娟院士的重大成果——找到很有效的抗病毒的药物阿比朵尔(arbidol)和达芦那韦 (Darunavir) , 所做的其实不过是体外试验 , 且阿比朵尔的有效浓度是10~30个微摩尔 , 达芦那韦是300微摩尔浓度 。 这种体外上千倍浓度的药量根本不可能用到体内 , 有专家甚至评论 , 可能得吃上万片药才能在体内达到这个浓度 , 副作用将远远超出药效 。 不过 , 本刊从中国临床试验注册中心查到 , 目前有关阿比多尔的新冠临床研究已经有4项 , 且阿比多尔已经写入了最新的《新型冠状病毒肺炎诊疗方案(试行第六版)》 。 对此 , 王俊表示 , “不清楚为什么会加入阿比多尔 , (目前)没有试验数据表明阿比多尔对新型冠状病毒有效” 。 03 该上的试验被挤占资源 值得警惕的是 , 正是很多没有什么逻辑的药物纷纷加入了新冠治疗的临床试验 , 本该有希望的药物却可能因为缺乏病人等原因 , 难以达到理想的预期结果 。 在2月24日晚世界卫生组织-中国冠状病毒病联合专家考察组召开的新闻发布会中 , 世卫组织代表布鲁斯·艾尔沃德(Bruce Aylward)博士的一番话颇耐人寻味 。 他谈到 , 在武汉考察时碰到了一位名叫曹彬的研究人员 , 是负责抗病毒药物开发的 。 他问曹彬 , 研发抗病毒药物过程中最大的挑战是什么?曹彬回答说 , 现在是招募病人 , 因为病人数目在下降 。 这固然是值得庆祝的消息 , 但随后在向全球提出的最后一点建议中 , 这位世卫组织代表提到其它的试验研究挤占了本该有希望的研究 , 比如曹彬正在领衔开展的瑞德西韦的临床研究—— “这一段争取来的宝贵时间要用好 , 尽管我们列出了很长的研究清单 , 但也强调研究项目应该有优先次重 , 以便快速地掌握知识以进一步阻断病毒传播 , 进一步降低重症率及病死率 。 我们认为瑞德西韦可能有预期效力 。 比如我见到研究人员曹彬说现在招募病人变难了 , 不仅是因为病例减少了 , 而是同时还在开展其他试验研究 , 而这些并未见得有多么大的希望 。 所以我们需要开始优先那些可能帮助我们更快挽救生命的研究项目 。 这不是中国独有的问题 , 也是全球的问题 。 ” 布鲁斯·艾尔沃德还强调 , “我们认为 , 目前只有一种药可能真正有效 , 这就是瑞德西韦” 。
推荐阅读
-
苹果手机|华为新机,双卡+Wi-Fi 6+,会是谁? | iPhone SE 2官方降价,国行2399起?
-
自动挡的"S“挡和”sport"按键 sport是什么意思
-
“我想要的一直都是被坚定的选择” | Soul星研究:你有“真正去爱”的能力吗?
-
-
[坦言]收入提高了?滴滴司机坦言:因为平台这波操作,现在收入
-
-
-
-
环球火力配30mm火神机炮,发动机被打烂都能返航,全球最彪悍的攻击机
-
炼化|华泰证券:看好基础原料环节的龙头公司(附股)
-
「王者荣耀」王者荣耀:评分最高只能16?玩家一场对局感动官方,得分突破记录
-
华为Mate30华为手机太多,不知道怎么选?看看这三款,口碑超好
-
英语老司机|怒怼特朗普的人走了…“中国外交天团”换人了!发言人耿爽卸任
-
阿力讲星座|8月里,越来越有钱的生肖,7月下旬日子红红火火
-
威宁|网传大山深处出现诡异“龙吟”声?调查结果来了!
-
-
-
游戏大妹子|金角刚被转到辅助位置,如今宣布回归AD位,BLG无人可用
-
【汽车冷知识】电动航空座椅/升降橱柜//旋转马桶,五一房车展:新款飞翔T型房车
-







![[坦言]收入提高了?滴滴司机坦言:因为平台这波操作,现在收入](/renwen/images/defaultpic.gif)











