卢米纳罕见肝病获FDA认定 武田又一新药获批中国临床研究
随着经济发展 , 社会对于罕见病的重视程度逐渐攀升 , “渐冻人”、“瓷娃娃”等特殊患病群体逐渐走进大众的视野 。 卢米纳制药、夏尔、葛兰素史克、罗氏等前沿药企都将罕见病研发提上了议程 , 据报道 , 全球有7000种以上的人类罕见病 , 但已有获批药物的不超过5% 。 所幸 , 随着各大药企的加速推进 , 现状正在往好的方向发展 。 下方为近期国际罕见病重大进展盘点:
文章图片
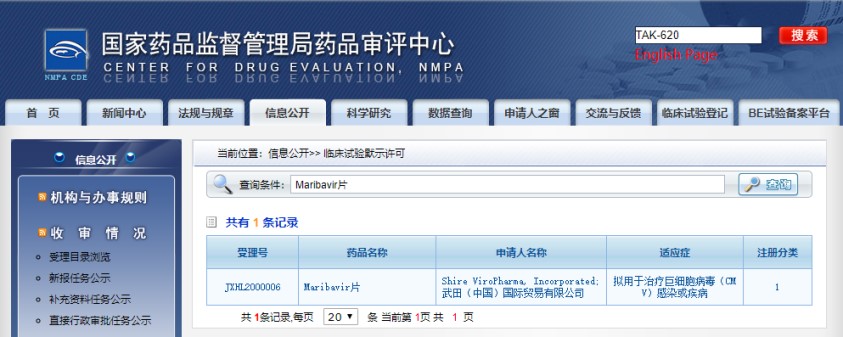
据中国药监局药品审评中心(CDE)网站公示 , 武田(Takeda)旗下用于治疗器官移植术后最常见的巨细胞病毒感染/疾病的maribavir片(TAK-620) , 已在中国获批临床研究 。
2019年1月 , 武田实现了对罕见病大型制药企业夏尔的成功并购 , 进一步填补了其在罕见病领域的市场蓝海 , 完成从化学制药到生物制药的转型 , 随之一起被并入的研发管线中就包括这款潜在“best-in-class”药物maribavir , 这也是武田有望在5年内上市的7款罕见病新药之一 。
此外 , 夏尔作为一家以并购战略站稳罕见病头部地位的药企 , 其在2014年收购卢米纳制药后获得了两款针对罕见肝病的药物 。 目前 , 卢米纳旗下这两款药物已在Alagille综合征和PFIC小儿患者体内得到了安全性和有效性验证 , 且获得了FDA授予的突破性疗法认定 。
5月22日 , 中国药监局药品审评中心网站公示 , 葛兰素史克旗下的抗体偶联药物belantamab mafodotin(GSK2857916)在中国获批临床研究 , 该药物将与硼替佐米和地塞米松联合用于既往接受过蛋白酶体抑制剂和免疫调节剂治疗的复发性、难治性的多发性骨髓瘤成人患者 。
这是葛兰素史克公司的重点研发项目之一 , 其作用靶点B细胞成熟抗原(BCMA)也是近年来的研究热门之一 , 目前该疗法的生物制品许可申请正在接受FDA审批 。
5月21日 , 罗氏旗下基因泰克公布 , 其针对视神经脊髓炎光谱症(NMOSD)的一种皮下注射药物Satralizumab在临床III期试验中显示出良好的耐受性 。 NMOSD是一种导致失明、肌无力甚至瘫痪的中枢神经系统罕见病 , 目前尚无任何获批药物 。
值得庆幸的是 , Satralizumab在青少年受试者中表现出与成年受试者一致的积极效果 , 这一潜在药物为这些青少年患者带去了希望 。
【卢米纳罕见肝病获FDA认定 武田又一新药获批中国临床研究】在医药界 , 各大制药巨头的企业价值观均是“以患者为先” , 而在覆盖患者人口仅占0.65‰~1‰的罕见病领域则更是如此 。 武田、夏尔(包括此前并购的Baxalta、卢米纳)、葛兰素史克、罗氏等全球药企巨头都从侧面验证了制药先锋乔治·W·默克博士的那句名言:“我们当永远铭记 , 制药的本质是为了人 , 而不是为了追逐利润 。 只要我们记住了这一点 , 利润必将应声而来 。 ”
推荐阅读
- 仙女娱八卦|蒋依依的发际线有多罕见?看清形状,网友:我这辈子都羡慕不来
- 西装|撒贝宁罕见和妻子出行,戴眼镜斯文又朴素,老婆穿紧身裤秀大长腿
- 甜味萌萌|王心凌罕见生气了脱口而出秒被消音,我最近听杨丞琳的歌
- 甘地传@“圣雄甘地”罕见老照片:与少女同浴同睡,死后其骨灰遭信众疯抢
- 『美国』一旦三战爆发,主战场会是哪个国家?美俄专家罕见达成一致
- 封面新闻|长白山顶峰现罕见佛光 你想许个什么愿?
- 每日经济新闻|日本熊本县遇罕见暴雨致15人心肺停止,熊本县和鹿儿岛约8000户家庭被断电
- 李凡看军事|美俄罕见强烈反对,乌克兰出售导弹研发技术?射程超过16000公里
- 椰子|45岁吴彦祖罕见直播,头秃发福:放纵欲望,会让人变平庸
- cba|历史罕见!两大旅美小将决定参加CBA选秀大会,谁能成为状元?















