『乙肝』乙肝在研新药终止研发,基于靶向先天免疫
文章图片

文章图片
去年年底 , 处于临床阶段的生物制药公司springbank终止了基于靶向天然免疫防御途径的乙肝新药sb9200的研发 , 值得一提的是 , Gileadscience的gs9688和Roche的ro7020531都是基于这一新靶点 , 但他们的新药测试仍在顺利进行 。
正在开发的治疗乙肝的新药已经终止 , 基于靶向天然免疫 , sb9200在早期表现良好
虽然sb9200终止了药物的研发进程 , 但让我们简单介绍一下基于靶向免疫防御的药物研发过程 , 属于免疫调节剂 , 早期还介绍了它可以在肝细胞核内治疗乙型肝炎病毒 , 只有小分子药物才能做到 , 因此 , sb9200也是一种小的二核苷酸 , 主要是口服给药 , 主要亮点是刺激宿主的抗病毒反应 , 同时直接调节机体的免疫功能 。
【『乙肝』乙肝在研新药终止研发,基于靶向先天免疫】富马酸替诺福韦联合富马酸依拉麻(TAF)试验第二阶段 , 观察到受试者肝功能转氨酶升高 , 表明转氨酶升高与自身免疫刺激无关 , 与肝损伤直接相关 , 因此 , 公司决定终止对sb9200的后续研发 , 公司前期公布的测试数据仍相对乐观 , 试验设计是结合sb9200识别受体RIG-I增强与HBV前基因组RNA的结合 , 置换和防止病毒pgRNA的倾覆 , 有效减少HBV复制物的形成 , 这是终止乙型肝炎新药的抗病毒原理 。
在联合治疗的第二阶段 , 30名受试者接受低剂量TAF和sb9200治疗12周 , 另外 , 12例慢性乙型肝炎(CHB)患者单独应用TAF治疗12周 , 治疗后 , 两个对照组继续单独使用TAF达36周 , 第一组治疗12周后 , 30例sb9200联合TAF患者中有7例HBsAg水平持续下降 , 即HBsAg反应良好 , 符合联合用药的疗效评价 。
当比较试验设计的基线和治疗结束后 , 这部分联合用药的受试者HBsAg下降等于或低于基线水平 , 如果排除本文开头提到的两个病例 , 事实上 , 其余28名患者中的5名在治疗12周后将继续降低HBsAg , 在单药试验组中 , 单独使用TAF的12人中有3人对表面抗原有良好反应 , 而单独使用sb9200的14人中只有1人在治疗12周后有反应 。
不难看出 , 本试验是观察单用TAF或单用sb9200与联合用药的疗效比较 , 观察到治疗后12周内仅发生轻度和中度严重不良事件 , 未发生严重不良事件 , 符合慢性乙型肝炎患者的安全性和耐受性评价 , 但sb9200后续递增剂量组分别为200mg和400mg继续对该组合的安全性、耐受性和有效性进行评估 。
在试验的第二阶段 , 在使用400mgSB9200期间 , 在增加剂量组中观察到3人转氨酶升高和肝功能障碍 , 尽管sb9200是一种针对先天免疫防御系统的新型药物靶点 , 但该试验于去年12月宣布 , 受试者的肝功能异常与免疫功能的激活无关 , 因此 , 公司立即对受试者暂停了sb9200的后续用药 , 同时也暂停了sb9200的后续研发 。
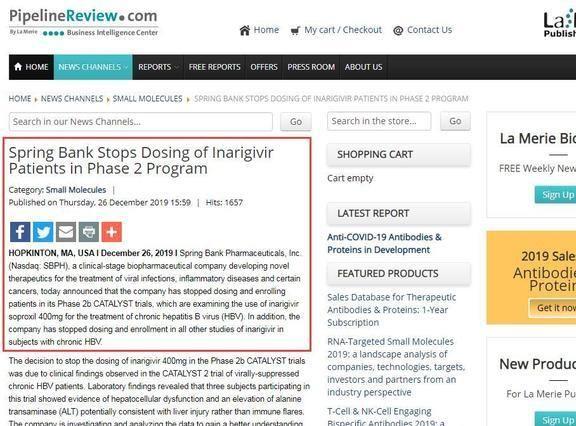
结论:公司关于终止该新药的公告可以在开篇截图中看到 , 感兴趣的读者也可以了解 , 在实验设计结果中 , 安全性评价有时比治疗效果更为重要 , 目前 , 能够进入研发中的乙肝新药2b期的患者寥寥无几 , 由于sb9200证明了sb9200引起的肝损伤与机体免疫功能的激活无关 , 因此直接终止sb9200的研究开发成为关键原因 。
科学研究不能模棱两可 , 毒品是一种特殊商品 , 如果说有近100种药物可以进入人体临床试验的第一阶段 , 那么只有10种新药可以进入第二阶段甚至第三阶段 , 新药开发的可能性相对较低 , 因此 , 我们将继续关注已经进入第二阶段的新型乙型肝炎药物 , 它们具有更大的潜力 。
推荐阅读
- [木易机械]中国警告之外,华为的全球5G之路有多难?,德国又终止合作华为
- 『海峡资讯』中国华为的全球5G之路有多难?,国际观察丨德国突然终止合作华为
- 趣味社会学■下一目标是中国联通?,美方欲吊销并终止中国电信在美通信授权
- 「健识局」中国试验提前终止,“人民的希望”公布结果:重症死亡率13%


















