еӣҪеҶ…й«ҳж ЎеӨ§зҲҶеҸ‘пјҒд»Ҡж—Ҙжё…еҚҺ/еҢ—еӨ§/еҺҰеӨ§NatureйҪҗеҸ‘( дәҢ )
第дәҢзҜҮпјҡеҢ—дә¬еӨ§еӯҰNatureпјҡNAD+д»ӢеҜјзҡ„зҘһз»ҸйҖҖиЎҢжҖ§иӣӢзҷҪиҮӘжҲ‘жҠ‘еҲ¶жңәеҲ¶
 ж–Үз« жҸ’еӣҫ
ж–Үз« жҸ’еӣҫ
▲第дёҖдҪңиҖ…пјҡYuefeng JiangйҖҡи®ҜдҪңиҖ…пјҡJing Yang пјҢZhe Zhang
йҖҡи®ҜеҚ•дҪҚпјҡеҢ—дә¬еӨ§еӯҰ пјҢ з”ҹе‘Ҫ科еӯҰеӯҰйҷў
DOI: 10.1038/s41586-020-2862-z
иғҢжҷҜд»Ӣз»ҚиҪҙзӘҒзҡ„з—…зҗҶеҸҳжҖ§з ҙеқҸдәҶзҘһз»Ҹеӣһи·Ҝ пјҢ жҳҜзҘһз»ҸйҖҖиЎҢжҖ§еҸҳзҡ„зү№еҫҒд№ӢдёҖ гҖӮ Sarm1жҳҜзҘһз»ҸйҖҖиЎҢжҖ§иҝҮзЁӢзҡ„дёӯеӨ®и°ғиҠӮеӣ еӯҗ пјҢ е…¶TIRеҹҹйҖҡиҝҮNADй…¶жҙ»жҖ§еҸ‘жҢҘзҘһз»ҸйҖҖиЎҢжҖ§дҪңз”Ё гҖӮ 然иҖҢ пјҢ Sarm1жҝҖжҙ»зҡ„дёҘж јжҺ§еҲ¶иғҢеҗҺзҡ„жңәеҲ¶д»Қжңүеҫ…е®Ңе…ЁзҗҶи§Ј гҖӮ
жң¬ж–Үдә®зӮ№1. жң¬ж–ҮжҠҘе‘ҠдәҶе…Ёй•ҝSarm1иӣӢзҷҪиҙЁеңЁ2.6-3.0еҹғеҲҶиҫЁзҺҮдёӢзҡ„еҶ·еҶ»з”өй•ңз»“жһ„ гҖӮ 2. дҪңиҖ…еҸ‘зҺ°NAD+жҳҜARMз»“жһ„еҹҹзҡ„ж„ҸеӨ–й…ҚдҪ“ гҖӮ иҝҷз§ҚNAD+з»“еҗҲдҝғиҝӣдәҶARMз»“жһ„еҹҹйҖҡиҝҮе…¶з»“жһ„еҹҹжҺҘеҸЈжҠ‘еҲ¶TIRз»“жһ„еҹҹзҡ„NADй…¶ гҖӮ 3. NAD+з»“еҗҲдҪҚзӮ№зҡ„з ҙеқҸжҲ–ARM-TIRзӣёдә’дҪңз”Ёеј•иө·з»„жҲҗжҖ§жҙ»жҖ§зҡ„Sarm1дјҡеҜјиҮҙиҪҙзӘҒеҸҳжҖ§ гҖӮ 4. иҝҷдәӣеҸ‘зҺ°жҸӯзӨәдәҶиҝҷз§Қж–°зҡ„NAD+д»ӢеҜјзҡ„дёӯжһўзҘһз»ҸйҖҖиЎҢжҖ§еҸҳиӣӢзҷҪзҡ„иҮӘжҲ‘жҠ‘еҲ¶ гҖӮ
еӣҫж–Үи§Јжһҗ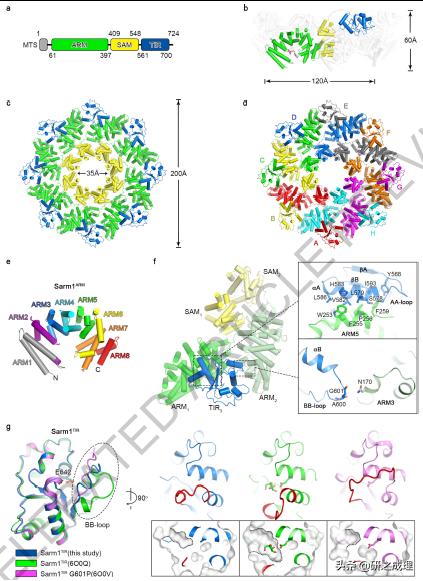 ж–Үз« жҸ’еӣҫ
ж–Үз« жҸ’еӣҫ
в–Іеӣҫ1 йҖҡиҝҮдёҺSarm1ARMдәӨдә’ пјҢ Sarm1TIRиў«йҷҗеҲ¶еңЁйқһжҙ»еҠЁзҠ¶жҖҒ гҖӮ пјҲaпјү Sarm1зҡ„зӨәж„Ҹеӣҫ гҖӮ зәҝзІ’дҪ“йқ¶еҗ‘еәҸеҲ—иӮҪпјҲMTSпјүгҖҒSarm1ARMгҖҒSarm1SAMе’ҢSarm1TIRеҲҶеҲ«з”ЁзҒ°иүІгҖҒз»ҝиүІгҖҒй»„иүІе’Ңи“қиүІиЎЁзӨә гҖӮ пјҲbпјү Sarm1е…«иҒҡдҪ“зҡ„дҫ§и§Ҷеӣҫ гҖӮ Оұ-иһәж—ӢзәҝжҳҫзӨәдёәеңҶжҹұдҪ“ гҖӮ NAD+еҲҶеӯҗжҳҫзӨәдёәжЈ’зҠ¶ гҖӮ дёҖдёӘеҺҹз”ҹиҙЁдҪ“зҡ„йўңиүІдёҺпјҲaпјүдёӯзӣёеҗҢ гҖӮ е…¶д»–зҡ„еҺҹз”ҹиҙЁжҳҜзҒ°иүІзҡ„ гҖӮ з»ҷеҮәдәҶе…«иҒҡдҪ“зҡ„еҺҡеәҰе’ҢдёҖдёӘеҺҹиҒҡдҪ“зҡ„й•ҝеәҰ гҖӮ пјҲc-dпјүдёҚеҗҢз»“жһ„еҹҹпјҲcпјүжҲ–еҺҹз”ҹиҙЁдҪ“пјҲdпјүзқҖиүІзҡ„Sarm1е…«иҒҡдҪ“дҝҜи§Ҷеӣҫ гҖӮ з»ҷеҮәдәҶзҺҜеҪўз»“жһ„зҡ„еҶ…еҫ„е’ҢеӨ–еҫ„ гҖӮ пјҲeпјүSARM1иҮӮзҡ„еңҶжҹұдҪ“иЎЁзӨә гҖӮ пјҲfпјүSarm1иҝһжҺҘSarm1е…«иҒҡдҪ“зҡ„з»„иЈ… гҖӮ еӣҫдёӯжҳҫзӨәдәҶдёүдёӘеҺҹиҒҡдҪ“зҡ„дә”дёӘз»“жһ„еҹҹ пјҢ е®ғ们з”ұ1еҲ°3зҡ„дёҚеҗҢдёӢж ҮиЎЁзӨә гҖӮ еҸідҫ§иҜҰз»ҶжҳҫзӨәдәҶдёӨдёӘSarm1ARM-Sarm1TIRжҺҘеҸЈ гҖӮ пјҲgпјүе·ҰеӣҫпјҡдёүдёӘSarm1TIRз»“жһ„зҡ„еҸ еҠ гҖӮ Sarm1TIRеңЁжҲ‘们зҺ°жңүзҡ„е…Ёй•ҝSarm1пјҲE642Aпјүз»“жһ„дёӯжҳҜи“қиүІзҡ„пјӣжҠҘе‘Ҡзҡ„еҚ•дёӘSarm1TIRпјҲPDBд»Јз Ғпјҡ6O0Qпјүе’ҢSarm1TIRпјҲG601PпјүпјҲPDBд»Јз Ғпјҡ6O0Vпјүзҡ„з»“жһ„еҲҶеҲ«жҳҜз»ҝиүІе’ҢзІүзәўиүІзҡ„ гҖӮ E642ж®Ӣеҹәзҡ„дҫ§й“ҫжҳҫзӨә пјҢ BBзҺҜиў«еңҲиө·жқҘ гҖӮ еҸіеӣҫпјҡдёүз§Қз»“жһ„дёӯNAD+еә•зү©дҪҚзӮ№зҡ„жҜ”иҫғ гҖӮ BBзҺҜжҳҜзәўиүІзҡ„ гҖӮ еңЁжүҖжҠҘйҒ“зҡ„Sarm1TIRз»“жһ„дёӯ пјҢ еҚ жҚ®NAD+еә•зү©дҪҚзҪ®зҡ„ж ёзі–еҲҶеӯҗжҳҫзӨәдёәжЈ’зҠ¶ гҖӮ NAD+еә•зү©дҪҚзӮ№зҡ„дёӯеҝғеҲҮзүҮжҳҫзӨәеңЁеә•йғЁ пјҢ жҳҫзӨәеҮәдёүз§Қз»“жһ„дёӯзҡ„еҸЈиўӢеҪўзҠ¶ гҖӮ
 ж–Үз« жҸ’еӣҫ
ж–Үз« жҸ’еӣҫ
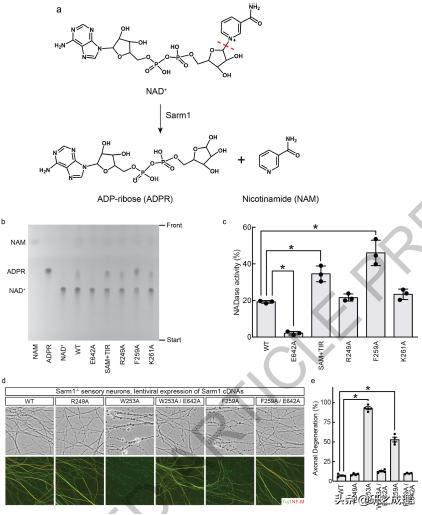
в–Іеӣҫ2 Sarm1ARMе’ҢSarm1TIRд№Ӣй—ҙиҮӘжҲ‘жҠ‘еҲ¶зӣёдә’дҪңз”Ёзҡ„еҠҹиғҪйӘҢиҜҒ гҖӮ пјҲaпјүSarm1еӮ¬еҢ–зҡ„NAD+иЈӮи§ЈеҸҚеә” пјҢ дё»иҰҒдә§зү©дёәNAMе’ҢADPR гҖӮ пјҲbпјүз”Ёи–„еұӮиүІи°ұжі•пјҲTLCпјүеҲҶжһҗNADaseзҡ„жҙ»жҖ§ гҖӮ д»Ҙ5 nmol-NAMгҖҒADPRе’ҢNAD+дёәж ҮеҮҶе“Ғ пјҢ еңЁи–„еұӮиүІи°ұжқҝдёҠжҳҫзӨәдәҶе®ғ们зҡ„иҝҒ移дҪҚзҪ® гҖӮ пјҲcпјүSarm1зӘҒеҸҳиӣӢзҷҪзҡ„NADPй…¶жҙ»жҖ§ гҖӮ NADй…¶жҙ»жҖ§з”ұNAD+е’ҢADPRејәеәҰд№Ӣе’Ң[IAPPR/пјҲINAD++IADPRпјү]еҪ’дёҖеҢ–еҗҺзҡ„ADPRејәеәҰи®Ўз®—NADй…¶жҙ»жҖ§ гҖӮ пјҲdпјүз”ұSarm1з»„жҲҗжҖ§жҝҖжҙ»еј•иө·зҡ„иҪҙзӘҒеҸҳжҖ§ гҖӮ е°ҶиЎЁиҫҫжҜҸдёӘSarm1зӘҒеҸҳиӣӢзҷҪзҡ„DIOзүҲжң¬зҡ„ж…ўз—…жҜ’дёҺиЎЁиҫҫCreзҡ„з—…жҜ’иҪҪдҪ“зӣёз»“еҗҲ пјҢ е°Ҷеҹ№е…»зҡ„Sarm1-/-ж„ҹи§үзҘһз»Ҹе…ғиҪ¬еҢ– гҖӮ иҪҙзҙўе®Ңж•ҙжҖ§йҖҡиҝҮзӣёе·®жҳҫеҫ®й•ңпјҲдёҠйғЁеҲҶпјүжҲ–жҠ—Tuj1пјҲз»ҝиүІпјү/жҠ—NF-MпјҲзәўиүІпјүе…ұе…Қз–«жҹ“иүІпјҲдёӢйғЁеҲҶпјүиҝӣиЎҢжЈҖжҹҘ гҖӮ пјҲeпјүиҪҙзӘҒеҸҳжҖ§е®ҡйҮҸ гҖӮ
 ж–Үз« жҸ’еӣҫ
ж–Үз« жҸ’еӣҫ
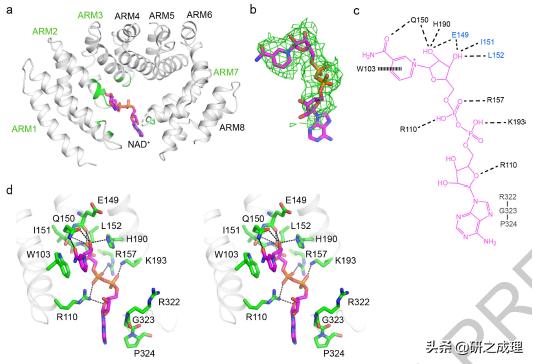
в–Іеӣҫ3 Sarm1ARMеҶ…NAD+з»“еҗҲдҪҚзӮ№ гҖӮ (a) NAD+з»“еҗҲзҡ„Sarm1ARMеңЁSarm1(E642A)з»“жһ„дёӯзҡ„жқЎеёҰиЎЁиҫҫ гҖӮ NAD+жҳҫзӨәдёәз”ұе…ғзҙ зқҖиүІзҡ„е“ҒзәўиүІжЈ’ гҖӮ е°ҶSarm1ARMеҸӮдёҺNAD+з»“еҗҲзҡ„еҢәеҹҹж Үи®°дёәз»ҝиүІ гҖӮ (b) з»“еҗҲNAD+еҲҶеӯҗзҡ„дҪҺжё©з”өй•ңеҜҶеәҰ гҖӮ иҜҘең°еӣҫзҡ„зӯүй«ҳзәҝй«ҳеәҰдёә6.0 гҖӮ (c) Sarm1ARMдёҺNAD+зӣёдә’дҪңз”ЁзӨәж„ҸеӣҫжҖ»з»“ гҖӮ иЎЁзӨәеҪўејҸ:еһӮзӣҙзәҝ пјҢ иҠійҰҷзӣёдә’дҪңз”Ё;иҷҡзәҝгҖҒж°ўй”®жҲ–зӣҗжЎҘ(
жҺЁиҚҗйҳ…иҜ»
- зғҹеҸ°жёҜвҖңз®ЎйҒ“жҷәи„‘зі»з»ҹвҖқдёҠзәҝ еңЁеӣҪеҶ…зҺҮе…Ҳе®һзҺ°еҺҹжІ№еӮЁиҝҗе…ЁжҒҜжҷәиғҪжҺ’дә§
- и…ҫи®ҜжёёжҲҸеҸ‘иө·еҜ№еҚҺдёәзҡ„жҢ‘жҲҳпјҢжҲ–еӣ еҗҺиҖ…еҜ№еӣҪеҶ…жүӢжңәеёӮеңәзҡ„еҪұе“ҚеҠӣеӨ§и·Ң
- иҷҫзұійҹід№җжӯЈејҸе®Је‘Ҡе…іеҒңпјҡеӣҪеҶ…йҹід№җе№іеҸ°з»Ҳе‘ҠеҲ«вҖңдёүеӣҪжқҖвҖқпјҢTMEдёҖ家зӢ¬еӨ§жҲ–е°ҶжҢҒз»ӯ
- ж¶ҲйҳІ|йҳҝйҮҢдә‘AIoTдә‘з«ҜдёҖдҪ“йҮҚзЈ…ж–°е“Ғ еӣҪеҶ…йҰ–ж¬ҫе®үж¶ҲдёҖдҪ“жңәиҜ„жөӢжҠҘе‘Ҡ
- вҖңеӣҪдә§жңәзҺӢвҖқзҡ„йҷЁиҗҪпјҢжӣҫи¶…и¶ҠеҚҺдёәжҲҗеӣҪеҶ…第дёҖпјҢд»ҠеҚҙйқ еҚ–иҖҒдәәжңәжұӮз”ҹ
- е–өеҚҡеЈ«иө„и®Ҝ | иҘҝе®үеҘҘдҪ“дёӯеҝғе»әжҲҗеӣҪеҶ…йҰ–дёӘ5GеңәйҰҶпјӣиӢ№жһңиў«жӣқе·ІејҖе§ӢеңЁе·ҘеҺӮжөӢиҜ•жҠҳеҸ еұҸiPhone
- жӣқеҸ°з§Ҝз”өе°Ҷиөҙж—Ҙжң¬е»әеҺӮпјҒеҸ°ж№ҫд№ӢеӨ–йҰ–ж¬Ў
- иў«ејәеҲ¶еӢ’д»Өд»ҺзҫҺеӣҪйҖҖеёӮпјҢдёүеӨ§иҝҗиҗҘе•ҶеӮ»зңјпјҢеӣҪеӨ–зҡ„й’ұжҜ”еӣҪеҶ…йҰҷпјҹ
- еұ•жңӣ2021пҪңиҝҗиҗҘе•Ҷи“„еҠҝ5Gж–°еҹәе»әпјҢ2021е№ҙжҲ–жҲҗ5Gеә”з”Ёз«ҜзҲҶеҸ‘е…ғе№ҙ
- 家用继з»ӯзҲҶеҸ‘ 2020е№ҙжҠ•еҪұеёӮеңәиҝҺжқҘеҶ°зҒ«дёӨйҮҚеӨ©