亚盛医药-B(06855)喜迎开门红 九获FDA孤儿药认证创中国药企之最
一直以来 , 亚盛医药细胞凋亡管线的研发进度备受资本和业界的期待 , 而公司也不负众望在近年来取得了众多突出的研发成就 。
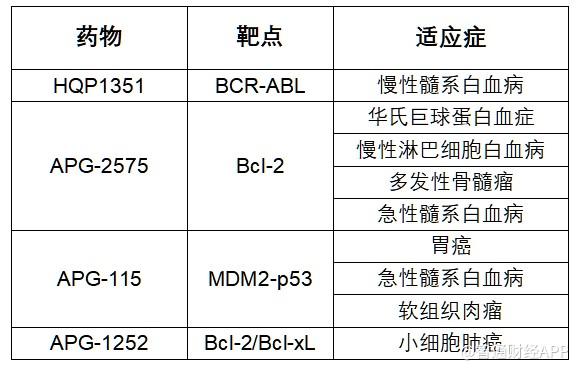
以在研原创新药Bcl-2抑制剂APG-2575为例 , 2020年 , APG-2575曾三获美国FDA孤儿药认证 , 帮助亚盛医药在三条适应症赛道建立了巨大的竞争优势 。 如今 , APG-2575再次获得一项FDA孤儿药认证 , 为亚盛医药在2021年的创新研发赢得一个漂亮的“开头彩” 。
【亚盛医药-B(06855)喜迎开门红 九获FDA孤儿药认证创中国药企之最】智通财经APP观察到 , 1月5日 , 亚盛医药-B(06855)宣布 , 美国食品和药品监督管理局(FDA)日前授予公司在研原创新药Bcl-2抑制剂APG-2575孤儿药资格认定 , 用于治疗急性髓系白血病(AML) 。 这是APG-2575继华氏巨球蛋白血症(WM)、慢性淋巴细胞白血病(CLL)、和多发性骨髓瘤(MM)适应症之后 , 获得的第四个FDA授予的孤儿药资格认定 。 截至目前 , 亚盛医药共有4个在研新药获得9项FDA孤儿药认证 , 创中国企业之最 。
AML是一种具有高度异质性的血液系统恶性肿瘤 , 且主要为一种老年患者疾病 , 诊断时的中位年龄为68岁 。 美国国家癌症所最新的SEER(Surveillance Epidemiology and End Results Program)预估数据显示 , 2020年美国将有19940例新诊AML病例 , 并将有11180人死于该疾病 。 尽管近年来在AML的治疗方面取得了一定进展 , 但该疾病的5年生存率为25%-30% , 因此临床上仍迫切需要更安全、更持久有效的治疗手段 。
“孤儿药”又称为罕见药 , 指用于预防、治疗、诊断罕见病的药品 。 在美国 , 罕见疾病是指患病人数少于20万人的疾病 。 自1983年以来 , 美国通过《孤儿药法案》的实施 , 给予企业相关政策扶持 , 以鼓励罕见病药品的研发 。 获得美国FDA授予的孤儿药资格认定 , 将有助于该药物在美国的后续研发及商业化开展等方面享受一定的政策支持 , 包括享有临床试验费用税收减免、免除NDA申请费用、获得研发资助等 , 特别是该药物该适应症批准上市后可获得美国市场7年独占权 。
随着中国医药创新力量的崛起 , 中国药企近年来的“出海”趋势日益明显 , 获得FDA孤儿药认定等资格认定也被视为重要的全球化创新实力指标之一 。 作为一直坚持全球创新的领军企业 , 亚盛医药无疑是其中佼佼者 。 截至现在 , 亚盛医药共有4个在研新药获得9项FDA孤儿药认证(见下表) 。 公开信息显示 , 该数量在中国企业中最为领先 。
 文章插图
文章插图
FDA批准的创新药数量的公开数据显示 , 近10年来 , 获得FDA批准的孤儿药在获批创新疗法中的比例逐步上升 。 2020年全年获批新药中获孤儿药资格的创新疗法的比例超过了60% , 创10年来占比的新高 。 这一数据表明 , FDA孤儿药资格认定的政策对于加快罕见病药物的研发、上市有着非常实际的激励与推动意义 。
亚盛医药董事长、CEO杨大俊表示:“我们在短短一年时间内 , 获得9项FDA孤儿药认证 , 无论在时间还是数量上 , 都是创下中国企业之最 , 甚至在全球范围内也应该是领先的 。 这一数据的背后 , 源于我们团队对于自身使命的坚守 , 即‘解决中国乃至全球患者尚未满足的临床需求’ 。 希望在FDA孤儿药政策的推动下 , 我们的多个药物能加快临床开发进度 , 早日获批 , 从而更快的造福更多患者 。 ”
推荐阅读
- 菏泽医药产业再传捷报 40亿大品种注射用头孢曲松钠通过一致性评价
- 糖化血红蛋白,单位有两个
- 跌打损伤,用黄硝苏木
- 每日医药——垂盆草
- 每日医药——干姜
- 平安好医生与天江药业达成战略合作,开启互联网+中医药新模式
- 每日医药——大黄
- 每日医药——青蒿
- 今年甘肃省中医药工作有哪些 快看《要点》咋说的
- 每日医药——附子