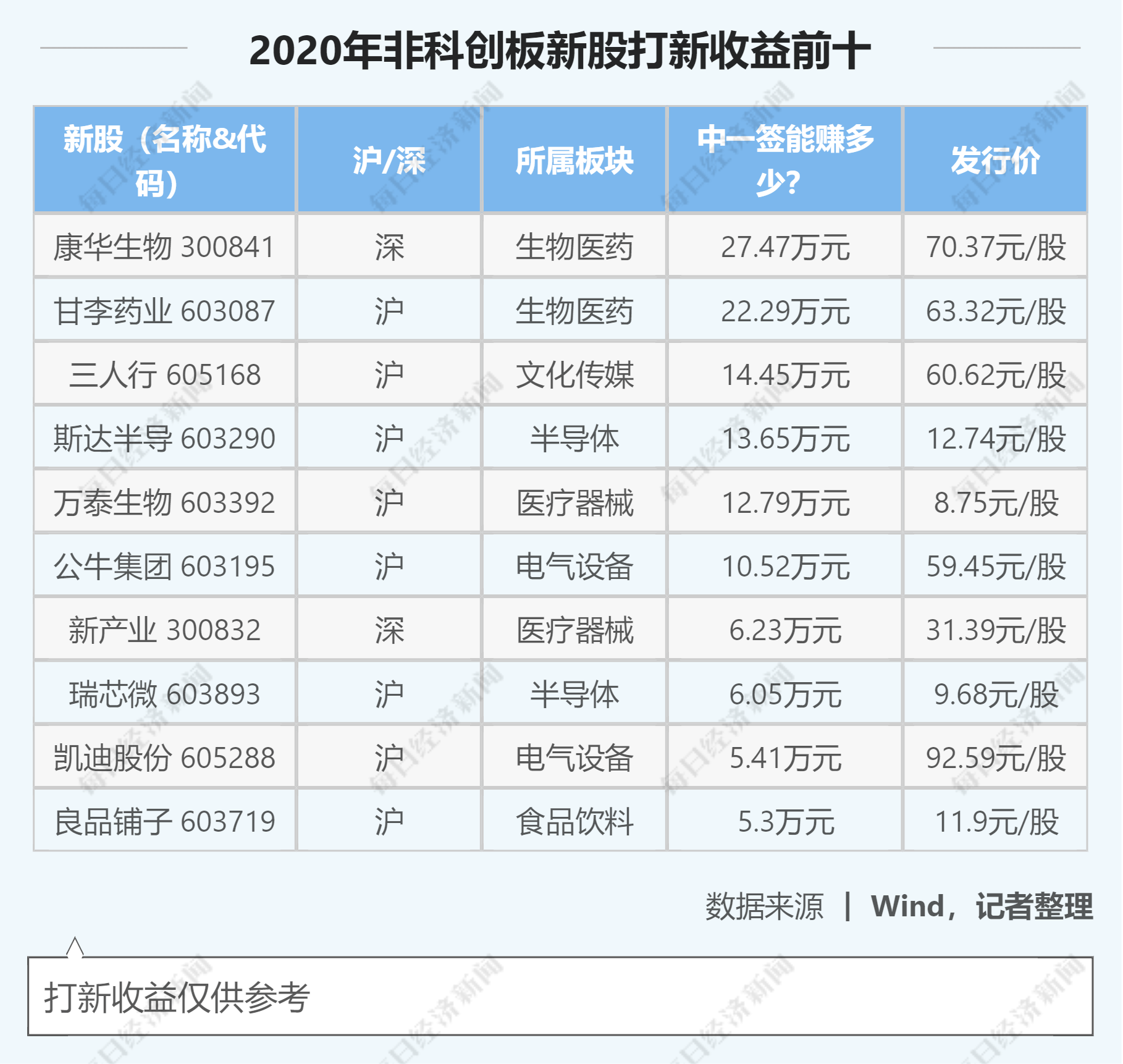
|иӣӢзҷҪиҙЁе…је…·еҸҜеЎ‘дёҺзЁіе®ҡжҖ§пјҹд»ҺиҝӣеҢ–и§Ҷи§’жҸӯзӨәз”ҹе‘ҪеӨҚжқӮзі»з»ҹзҡ„еҶ…еңЁе№іиЎЎ( дёү )
3. е®ҡйҮҸеҲҶжһҗе’Ңи®Ёи®ә
дёӢйқў пјҢ жҲ‘е°Ҷз®ҖеҚ•д»Ӣз»ҚдёҖдёӢжҲ‘们еҜ№иӣӢзҷҪиҙЁзі»з»ҹзҡ„еҠҹиғҪж•Ҹж„ҹжҖ§е’ҢзӘҒеҸҳзЁіе®ҡжҖ§зҡ„е®ҡйҮҸжҸҸиҝ° гҖӮ еӣ дёәиҝҷдёӘе·ҘдҪңзҡ„дё»иҰҒзӣ®зҡ„жҳҜдёәдәҶе»әжһ„е…ідәҺиӣӢзҷҪиҙЁвҖңеҹәеӣ еһӢвҖ”иЎЁзҺ°еһӢвҖқзҡ„зҗҶи®ә пјҢ дёәз®ҖеҚ•иө·и§Ғ пјҢ жҲ‘们иҝҷйҮҢд»…иҖғиҷ‘иӣӢзҷҪиҙЁзҡ„еӨ©з„¶жҖҒеҠЁеҠӣеӯҰ гҖӮ жӯӨж—¶ пјҢ жҲ‘们еҸҜд»Ҙе°ҶиӣӢзҷҪиҙЁзҡ„иҝҗеҠЁз®ҖеҢ–дёәеӨ©з„¶жҖҒпјҲиғҪйҮҸжңҖдҪҺз»“жһ„пјүйҷ„иҝ‘зҡ„жҢҜеҠЁ гҖӮ еңЁе®һи·өдёӯ пјҢ еҸҜд»Ҙз”Ёеј№жҖ§зҪ‘з»ңжЁЎеһӢпјҲelastic network modelпјүжқҘжҸҸиҝ°иӣӢзҷҪиҙЁзҡ„еӨ©з„¶жҖҒеҠЁеҠӣеӯҰ[4] пјҢ еңЁиҝҷз§ҚжЁЎеһӢдёӯ пјҢ жһ„жҲҗиӣӢзҷҪиҙЁзҡ„еҹәжң¬еҚ•е…ғпјҲж°Ёеҹәй…ёж®Ӣеҹәпјүиў«жҸҸиҝ°дёәдёҖзі»еҲ—зҡ„е°Ҹзҗғ пјҢ иҝҷдәӣе°Ҹзҗғд№Ӣй—ҙз”ұеј№з°§иҝһжҺҘ пјҢ иҝһжҺҘе…ізі»з”ұиӣӢзҷҪиҙЁзҡ„еӨ©з„¶жҖҒз»“жһ„еҶіе®ҡ гҖӮ иҝҷж · пјҢ иӣӢзҷҪиҙЁзҡ„жҢҜеҠЁй—®йўҳе°ұеҸҳжҲҗдәҶеҠӣеӯҰдёӯзҡ„дёҖдёӘз»Ҹе…ёй—®йўҳ пјҢ еҚіжұӮи§ЈиҖҰеҗҲжҢҜеӯҗзҡ„жҢҜеҠЁжЁЎејҸ пјҢ иҝҷдёӘй—®йўҳд№ҹдёҺз»“жһ„еҢ–еӯҰдёӯжұӮи§ЈеҲҶеӯҗзҡ„жҢҜеҠЁжЁЎејҸгҖҒжҲ–иҖ…еӣәдҪ“зү©зҗҶдёӯжұӮи§Јжҷ¶дҪ“дёӯзҡ„ж јжіўжҳҜзұ»дјјзҡ„ гҖӮ жіЁж„ҸеҲ°еј№жҖ§зҪ‘з»ңжЁЎеһӢжҳҜдёҖдёӘзәҝжҖ§жЁЎеһӢ пјҢ иҖҢеј№жҖ§зҪ‘з»ңзҡ„жӢ“жү‘з»“жһ„еҸҜд»Ҙз”ұиҜҘзҪ‘з»ңзҡ„жӢүжҷ®жӢүж–Ҝзҹ©йҳөпјҲgraph LaplacianпјүжҸҸиҝ° пјҢ иҜҘ Laplacianзҡ„зү№еҫҒеҖјпјҲeigenvalueпјүжӯЈжҜ”зӣёеә”жҢҜеҠЁжЁЎејҸзҡ„йў‘зҺҮзҡ„е№іж–№ пјҢ иҖҢдёҺиҝҷдәӣзү№еҫҒеҖјзӣёеҜ№еә”зҡ„зү№еҫҒеҗ‘йҮҸпјҲeigenvectorпјүеҲҷжҸҸиҝ°дәҶзӣёеә”жҢҜеҠЁжЁЎејҸзҡ„еҹәжң¬еҪўжҖҒ гҖӮ
жң¬ж–ҮжҸ’еӣҫ
гҖҗ|иӣӢзҷҪиҙЁе…је…·еҸҜеЎ‘дёҺзЁіе®ҡжҖ§пјҹд»ҺиҝӣеҢ–и§Ҷи§’жҸӯзӨәз”ҹе‘ҪеӨҚжқӮзі»з»ҹзҡ„еҶ…еңЁе№іиЎЎгҖ‘еӣҫ2. иӣӢзҷҪиҙЁзҡ„еӨ©з„¶жҖҒз»“жһ„пјҲе·ҰпјүдёҺе…¶жүҖеҜ№еә”зҡ„еј№жҖ§зҪ‘з»ңжЁЎеһӢпјҲеҸіпјүзӨәж„Ҹеӣҫ
жңүдәҶиҝҷж ·дёҖдёӘжЁЎеһӢжЎҶжһ¶ пјҢ жҲ‘们е°ұеҸҜд»ҘжқҘе®ҡйҮҸеҲ»з”»вҖңеҠҹиғҪж•Ҹж„ҹжҖ§вҖқе’ҢвҖңзӘҒеҸҳзЁіе®ҡжҖ§вҖқ гҖӮ еңЁжң¬ж–Үдёӯ пјҢ жҲ‘еёҢжңӣдёҚз”Ёе…¬ејҸ пјҢ д»Ӣз»Қзӣёе…іе®ҡд№үзҡ„еҹәжң¬жҖқи·Ҝ гҖӮ
жң¬ж–ҮжҸ’еӣҫ
еӣҫ3. иӣӢзҷҪиҙЁзҡ„еҠҹиғҪж•Ҹж„ҹжҖ§пјҲAпјүдёҺзӘҒеҸҳзЁіе®ҡжҖ§пјҲBпјүзҡ„е®ҡд№үзӨәж„Ҹеӣҫ
еҰӮеүҚжүҖиҝ° пјҢ еҠҹиғҪж•Ҹж„ҹжҖ§жҸҸиҝ°зҡ„жҳҜзі»з»ҹеңЁеӨ–з•Ңжү°еҠЁдёӢзҡ„е“Қеә”жғ…еҶө гҖӮ ж №жҚ®иҝҷдёӘе®ҡд№ү пјҢ еҫҲе®№жҳ“жғіеҲ° пјҢ еңЁзӣёеҗҢзҡ„еҷӘеЈ°жғ…еҶөдёӢ пјҢ з»“жһ„ж¶ЁиҗҪи¶ҠеӨ§зҡ„еҲҶеӯҗеҠҹиғҪж•Ҹж„ҹжҖ§и¶Ҡй«ҳ пјҢ иҖҢиҝҷдёӘж¶ЁиҗҪзҡ„еӨ§е°ҸеҸҜд»Ҙз”ЁиӣӢзҷҪиҙЁзҡ„жһ„иұЎзҶөпјҲconformation entropyпјүжқҘжҸҸиҝ° пјҢ зҶөи¶ҠеӨ§ пјҢ еҸҜиғҪзҡ„з»“жһ„ж•°д№ҹе°ұи¶ҠеӨҡ гҖӮ з»ҸиҝҮж•°еӯҰжҺЁеҜј пјҢ еҸҜд»ҘеҸ‘зҺ° пјҢ иҝҷдёӘзҶөдёҺжҢҜеҠЁи°ұдёӯжҢҜеҠЁйў‘зҺҮпјҲзү№еҫҒеҖјпјүзҡ„д№ҳз§Ҝзҡ„еҜ№ж•°жңүе…і гҖӮ еҪ“жүҖжңүйў‘зҺҮзҡ„д№ҳз§Ҝи¶Ҡе°Ҹж—¶ пјҢ зі»з»ҹзҡ„зҶөи¶ҠеӨ§ пјҢ иҝҷдёӘз»“жһңжңүеҫҲзӣҙи§Ӯзҡ„ж„Ҹд№ү гҖӮ дёҖж–№йқў пјҢ иҝҷдёӘд№ҳз§ҜеҸҜд»ҘзңӢжҲҗжҳҜй«ҳз»ҙз©әй—ҙдёӯзҡ„дёҖдёӘжӨӯзҗғ пјҢ жӨӯзҗғзҡ„еӨ§е°ҸеҚідёәжһ„иұЎз©әй—ҙзҡ„дҪ“з§ҜпјӣеҸҰдёҖж–№йқў пјҢ иҝҷдёҖз»“жһңд№ҹжңүеҫҲзӣҙи§Ӯзҡ„зү©зҗҶж„Ҹд№ү пјҢ еҰӮжһңдёҖдёӘзі»з»ҹжңүеӨ§йҮҸдҪҺйў‘зҡ„жЁЎејҸ пјҢ йӮЈд№ҲеҫҲе°Ҹзҡ„иғҪйҮҸе°ұиғҪжҝҖеҸ‘еҮәзі»з»ҹеӨ§жҢҜе№…зҡ„иҝҗеҠЁ гҖӮ еҪ“жҲ‘们еёҢжңӣжңҖеӨ§еҢ–дёҖдёӘиӣӢзҷҪиҙЁеҲҶеӯҗзҡ„жһ„иұЎзҶөж—¶ пјҢ жҲ‘们е®һйҷ…дёҠжҳҜеёҢжңӣиҝҷдёӘеҲҶеӯҗжңүе°ҪеҸҜиғҪеӨҡзҡ„дҪҺйў‘зҡ„жҢҜеҠЁжЁЎејҸ гҖӮ жҚўеҸҘиҜқиҜҙ пјҢ жҲ‘们еёҢжңӣиҝҷдёӘеҲҶеӯҗзҡ„жҢҜеҠЁи°ұдёӯжңүеӨ§йҮҸйӣҶдёӯеңЁжҺҘиҝ‘0зҡ„зү№еҫҒеҖј гҖӮ
жҺҘзқҖ пјҢ жҲ‘们жқҘиҖғиҷ‘е®ҡйҮҸеҲ»з”»дёҖдёӘеҲҶеӯҗзҡ„вҖңзӘҒеҸҳзЁіе®ҡжҖ§вҖқ гҖӮ иҖҢжҲ‘们еңЁиҝҷйҮҢжүҖиҖғиҷ‘зҡ„вҖңзӘҒеҸҳвҖқ пјҢ жҳҜеҜ№зі»з»ҹеҶ…йғЁзҡ„жү°еҠЁ пјҢ жҚўеҸҘиҜқиҜҙ пјҢ жҳҜиҰҒеҜ№зҪ‘з»ңзҡ„жӢ“жү‘еҒҡдәӣж”№еҸҳ пјҢ зңӢзңӢз»ҸиҝҮиҝҷдёҖж”№еҸҳ пјҢ зі»з»ҹзҡ„еҠЁеҠӣеӯҰеҲ°еә•еҸ‘з”ҹдәҶдәӣд»Җд№ҲеҸҳеҢ– гҖӮ еүҚйқўжҸҗеҲ° пјҢ зү№еҫҒеҖјзӣёеҜ№еә”зҡ„зү№еҫҒеҗ‘йҮҸжҸҸиҝ°дәҶдёҺеҠҹиғҪзӣёе…ізҡ„жҢҜеҠЁжЁЎејҸзҡ„еҹәжң¬еҪўжҖҒ пјҢ еҰӮжһңеңЁзӘҒеҸҳеүҚеҗҺ пјҢ зӣёеә”зҡ„зү№еҫҒеҗ‘йҮҸжІЎжңүеҸ‘з”ҹеӨӘеӨ§зҡ„ж”№еҸҳ пјҢ еҲҷиҜҙжҳҺиҝҷдёӘзі»з»ҹе…·жңүиҫғй«ҳзҡ„зӘҒеҸҳзЁіе®ҡжҖ§ пјҢ иҖҢеҰӮжһңзҪ‘з»ңз»“жһ„зҡ„еҸҳеҢ–зү№еҫҒеҗ‘йҮҸеҸ‘з”ҹдәҶе·ЁеӨ§зҡ„ж”№еҸҳ пјҢ еҲҷиҜҙжҳҺзі»з»ҹеҜ№зӘҒеҸҳжҳҜж•Ҹж„ҹзҡ„ гҖӮ жҖҺж ·е®ҡйҮҸеҲ»з”»иҝҷз§ҚзЁіе®ҡжҖ§жҲ–ж•Ҹж„ҹжҖ§е‘ўпјҹж №жҚ®еҫ®жү°и®әпјҲжҲ–ж №жҚ®Davis-Kahanе®ҡзҗҶпјү пјҢ еҸҜд»ҘиҜҒжҳҺ пјҢ 第iдёӘзү№еҫҒеҗ‘йҮҸзҡ„зӘҒеҸҳзЁіе®ҡжҖ§дёҺе®ғжүҖеҜ№еә”зҡ„зү№еҫҒеҖјпјҲО»iпјүеҸҠе…¶иҝ‘йӮ»зҡ„зү№еҫҒеҖјпјҲО»i-1е’ҢО»i+1пјүд№Ӣй—ҙзҡ„и·қзҰ»пјҲgapпјүжңүе…і пјҢ еҰӮжһңиҰҒжңҖеӨ§еҢ–第iдёӘзү№еҫҒеҗ‘йҮҸзҡ„зЁіе®ҡжҖ§ пјҢ йӮЈд№ҲжҲ‘们йңҖиҰҒжңҖеӨ§еҢ–О»iе’Ңе®ғзӣёйӮ»зҡ„зү№еҫҒеҖјд№Ӣй—ҙзҡ„и·қзҰ» гҖӮ еҰӮжһңжҲ‘们еёҢжңӣи®©жүҖжңүзҡ„зү№еҫҒеҗ‘йҮҸйғҪе°ҪеҸҜиғҪзЁіе®ҡ пјҢ йӮЈд№ҲжҲ‘们йңҖиҰҒи®©жҢҜеҠЁи°ұдёӯ пјҢ еҗ„дёӘзү№еҫҒеҖјдёҺе®ғзҡ„иҝ‘йӮ»еҖјд№Ӣй—ҙзҡ„жңҖе°Ҹи·қзҰ»жңҖеӨ§еҢ– гҖӮ иҖҢиҰҒжңҖеӨ§еҢ–иҝҷдёӘжңҖе°Ҹи·қзҰ» пјҢ жҲ‘们жүҖжңҹеҫ…зҡ„жҳҜдёҖдёӘеқҮеҢҖзҡ„зү№еҫҒеҖјеҲҶеёғ гҖӮ
жҺЁиҚҗйҳ…иҜ»
- еӨ§и„‘|еӨ§и„‘еҸҜеЎ‘жҖ§ж„Ҹе‘ізқҖжҲ‘们жҜҸеӨ©йғҪдјҡеҸҳжҲҗдёҖдёӘдёҚдёҖж ·зҡ„дәә
- иһҚиө„并иҙӯ|жҷҜжқ°з”ҹзү©е®ҢжҲҗ5.3дәҝе…ғBиҪ®иһҚиө„пјҢиҒҡз„ҰиӣӢзҷҪиҙЁз»„еӯҰй©ұеҠЁзҡ„зІҫеҮҶеҢ»еӯҰ
- иҙЁж„ҹ|и…•дёҠзҡ„иүәжңҜе“ҒпјҒvivo WATCHе…је…·зҫҺж„ҹдёҺиҙЁж„ҹ
- еұҸ幕|vivo Y73sиҜ„жөӢпјҡиҪ»е·§ж— иҙҹжӢ…е…је…·дјҳз§ҖдҪ“йӘҢ