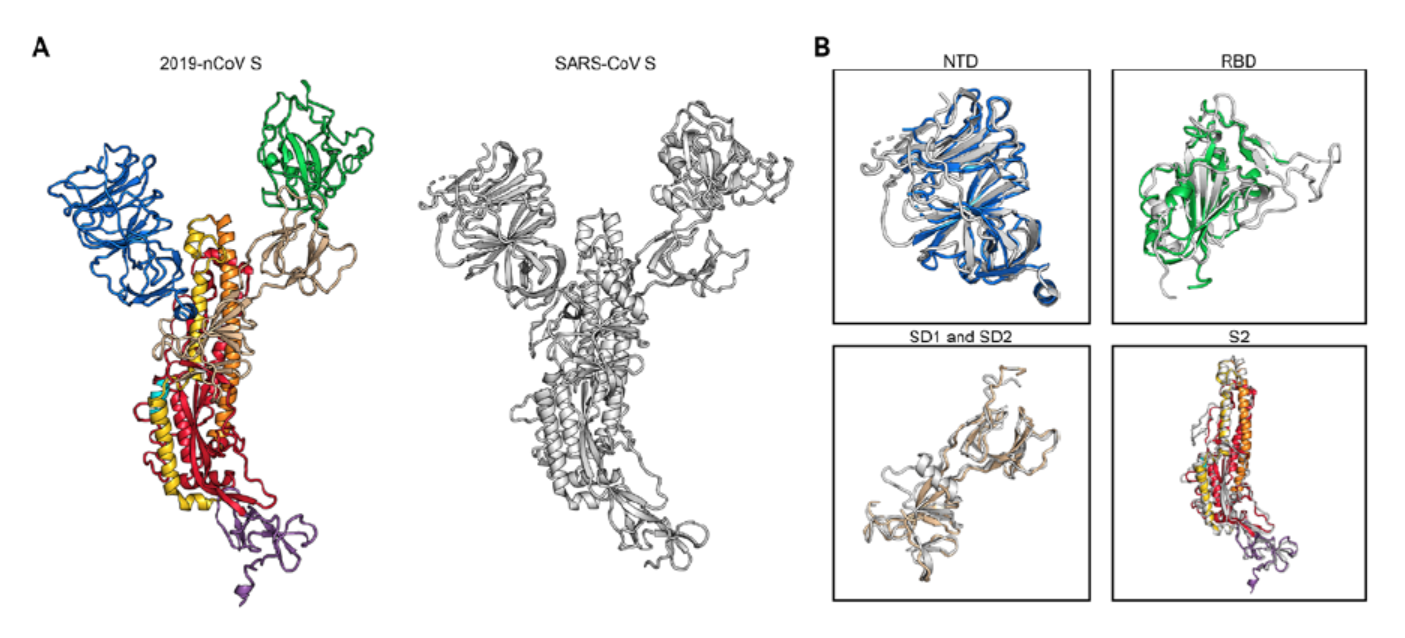
新型冠状病毒与SARS-CoV的结构异同比较 作者们发现 , 与SARS病毒相比 , 新型冠状病毒中的RBD结构更靠近三聚体的中央部位 , 处于“向下”构象的SARS-CoV的RBD则与相邻原聚体的N末端域(NTD)紧贴着 。 其S蛋白中3个RBD中的1个会向上螺旋突出 , 导致S1亚基的脱落和S2的折叠 , 从而使S蛋白更容易与宿主受体血管紧张素转换酶2(ACE2)结合 。 另外 , 先前有报道发现新型冠状病毒与SARS病毒共享形同的宿主细胞受体ACE2 , 作者们希望进行动力学方面的检测以进一步确认两者之间的不同 。 最近的报道表明 , 2019-nCoV的S蛋白和SARS-CoV的S蛋白有着相同的功能宿主细胞受体-血管紧张素转换酶2(ACE2) , 作者们通过表面等离子共振(SPR)的动力学手段量化了病毒与该受体的相互作用 。
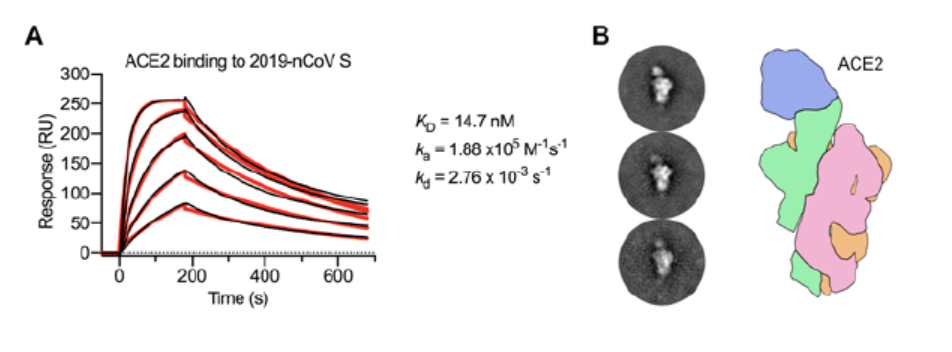
令人惊讶的是 , 通过表面等离子共振技术(SPR)分析得到的结果显示 , 新冠病毒S蛋白与ACE2的平衡解离常数KD是15 nM , 而SARS病毒S蛋白与ACE2的平衡解离常数KD达到了325.8 nM 。 KD值越大意味解离越多 , S蛋白与ACE2的亲和力越弱 。 经过计算 , 新冠病毒S蛋白与ACE2的亲和力 , 是SARS病毒S蛋白与ACE2之间亲和力10倍 , 甚至20倍 (上图A) 。 因此 , 研究团队认为 , 可能正是新型冠状病毒S蛋白与ACE2的高亲和力 , 让新冠肺炎在人与人之间传播变得容易 。 当然 , 还需要进一步研究确认这个结论 。 研究团队还形成了与新冠病毒的S蛋白胞外域结合的ACE2的复合物(上图B) , 并通过高分辨率冷冻电镜观察到 , 它与SARS-CoV的S蛋白和ACE2之间形成的复合物非常相似 。

新型冠状病毒病毒对于ACE2具有高亲和性 这也说明 , 新型冠状病毒侵入宿主的机制虽然与其他的冠状病毒科的病毒相似 , 但传染性更强 。 新冠病毒与蝙蝠冠状病毒RaTG13 除了SARS病毒之外 , 新型冠状病毒与蝙蝠冠状病毒RaTG13在S蛋白中序列同源性高达96% 。 但新型冠状病毒S蛋白最显著的不同是 , 其具有S1/S2蛋白酶切割位点的“RRAR”(弗林蛋白酶识别位点)氨基酸序列 , 而不是像SARS病毒中仅具有单个精氨酸 。 新冠病毒的这一现象在流感病毒中较为普遍 , 其中高毒力禽流感病毒和人流感病毒常发生流感血凝素蛋白的关键位置上产生多聚弗林蛋白酶位点的氨基酸插入 。 除了在S1/S2连接处的氨基酸残基差异外 , 新型冠状病毒和RaTG13病毒的S蛋白还存在29个氨基酸残基的差异 , 其中17个位于受体结合的RBD部位 。 团队还分析了全球共享禽流感数据倡议组织(GISAID)数据库中的61个新冠病毒的S序列 , 发现在所有保存的序列中只有9个氨基酸取代 。 这些取代中的大多数相对保守 , 预计不会对新冠病毒的S蛋白结构或功能产生重大影响 。 抗体实验 由于新型冠状病毒与SARS病毒之间的结构同源性且共用受体 , 作者们希望对已经发表的SARS病毒的RBD定向单克隆抗体(mAb)对新型冠状病毒的RBD进行交叉反应性测试 。 作者们通过BLI检测试剂盒评估了SARS-CoV RBD的定向单克隆抗体S230、m396和80R的交叉反应性 。
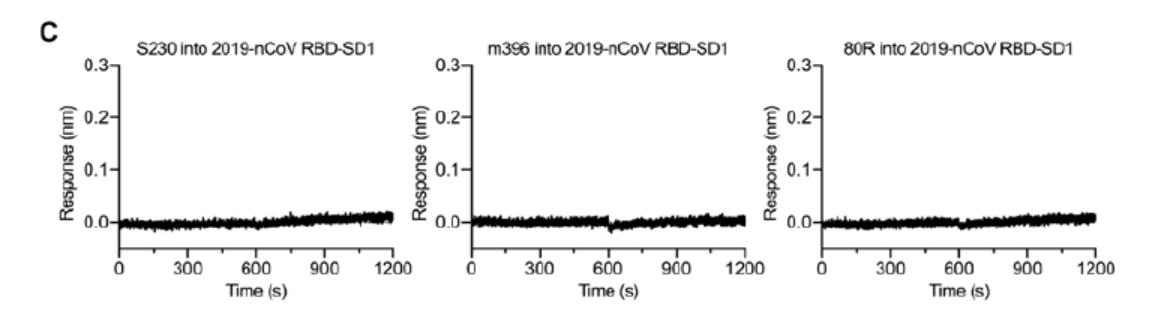
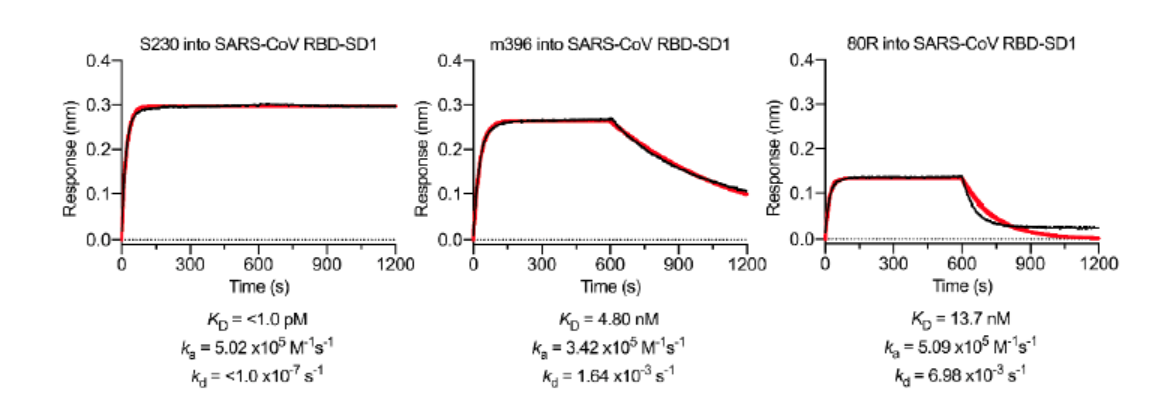
S230、m396和80R对于新冠病毒没有明显结合 但是作者们发现 , 尽管两病毒RBD之间结构高度相似 , 但是三种SARS病毒的RBD抗体在所测试的浓度(1μM)下 , 均未检测到与新冠病毒的RBD的结合 。 研究者们认为 , 尽管这三种抗体的表位仅占新冠病毒的RBD表面积的一小部分 , 但由于观察不到结合 , 可以认为针对SARS病毒的的抗体对新冠病毒不一定具有交叉反应性 , 但新型冠状病毒S蛋白作为未来抗体分离与治疗方案的设计将提供重要参考 。
推荐阅读
-
宋仲基|宋仲基和英国女友凯蒂·刘易斯·桑德斯的爱情故事
-
其他赛区|众解说预测LCK夏决:普遍看好DWG,仅两人认为DRX能险胜
-
-
大一绩点比较低,大二大三努力,出国有没有希望申请好学校
-
渝芃时尚达人|12500包包好奢侈,宋佳衣品又飒又美!衬衫配工装裤简约帅气
-
-
-
200年内地球会毁灭吗,霍金关于地球200年后的预言,是真的吗--
-
#搭配#韩国最萌身高差情侣,不用情侣款却穿出亲密感,每一张都像撒狗粮
-
-
向风而行|《向风而行》:托稳行业剧底线,拔高情感剧上限
-
国家|欧洲的美女“巨人国”:口味很独特,女游客最好别带男友来!
-
「社区」为居民送菜、为2500多楼栋单元消杀,机场集团200余志愿
-
-
-
潮男穿搭时尚社|白色V领针织衣搭配蓝色牛仔裤,简单大方,清新减龄
-
-
-
隐秘而伟大|足协不该实施限薪令,国足球员拿几百上千万年薪,是应该的!
-
魔兽世界|魔兽世界:28分钟单刷泰兰德,被无情“嘲讽”,铁炉堡也“陷落”






















