新冠为何更易传染?图解病毒进入细胞的“钥匙”
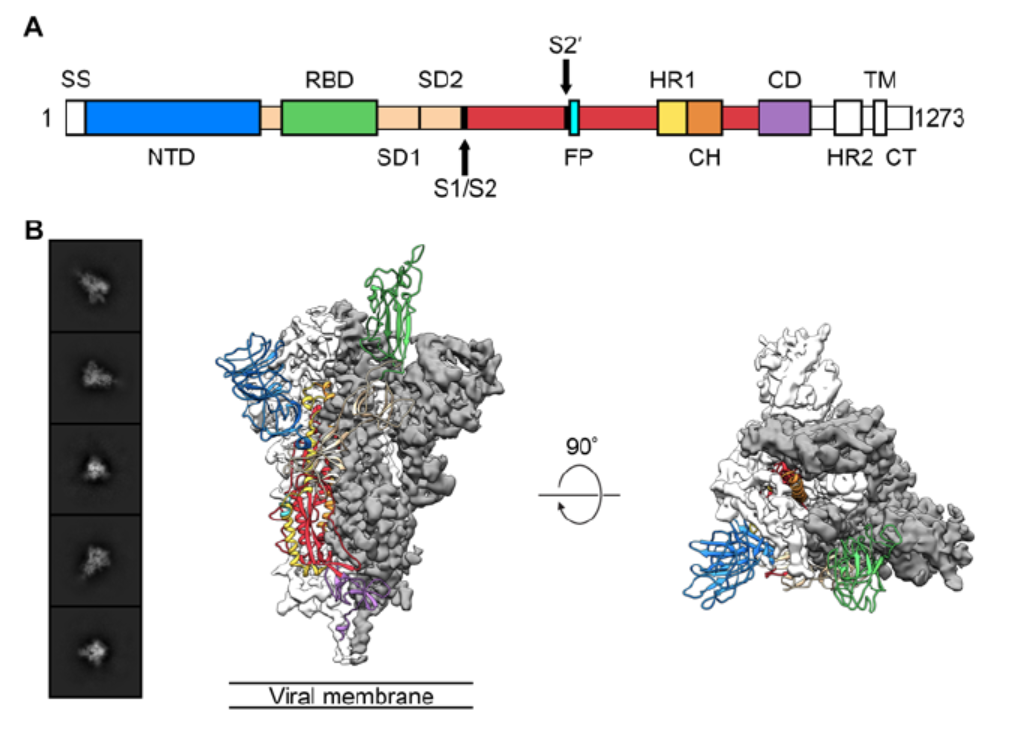
新冠病毒为何更易传染?冷冻电镜图解病毒进入细胞的“钥匙” 新冠病毒的传染性为何更强?科学家用“火眼金睛”的冷冻电镜技术 , 终于找到了其背后的原因——新冠病毒的关键刺突蛋白(S蛋白)与人体细胞的受体蛋白的亲和力 , 要远高于SARS-CoV 。 病毒要进入人体细胞 , 必须找到人体细胞上相应的受体蛋白 , 而每个受体好比是一把“锁” , 得有相应的“钥匙”才能打开 , 而后进入细胞内部 。 新冠病毒的“钥匙”就是S蛋白 。 新冠肺炎疫情暴发以来 , 新冠病毒与宿主细胞作用的关键刺突蛋白(S蛋白 , Spike glycoprotein)备受各研究团队的重视 。 当地时间2月15日 , 美国国立卫生研究院(NIH)疫苗研究中心与得克萨斯大学奥斯汀分校分子生物科学学院合作在生命科学预印本平台bioRxiv发表文章“Cryo-EM Structure of the 2019-nCoV Spike in the Prefusion Conformation”(论文未经同行评议) , 对新型冠状病毒的S蛋白进行了近原子结构分析 。 根据已经公开的基因组序列 , 研究团队合成并纯化了新型冠状病毒S蛋白的膜外部分 。 随后用冷冻电镜获得纯化S蛋白的3207张照片 , 经过3D重建 , 最终获得分辨率为3.5 Å的S蛋白三聚体结构 。 通过与SARS病毒的结构比较 , 研究团队认为 , 新冠病毒的S蛋白结合人体ACE2(宿主细胞受体血管紧张素转化酶2)的亲和力要远高于严重急性呼吸综合征冠状病毒(SARS-CoV)的S蛋白 , 这解释了为什么新冠病毒传染性要比SARS病毒强得多 。 研究团队还测试了几种已发布的SARS病毒RBD特异性单克隆抗体 , 发现它们与新冠病毒的S蛋白没有明显的结合 , 这表明两种病毒RBD之间的抗体交叉反应性可能受到限制 。 该论文的通讯作者为得克萨斯大学奥斯汀分校分子生物科学学院副教授Jason S. McLellan 。 McLellan是研究病毒的专家 , 此前在中东呼吸系统综合征冠状病毒(MERS-CoV)和埃博拉等病毒的结构方面做了很多非常重要的工作 , 包括利用冷冻电镜、X光结晶学等技术分析冠状肺炎病毒 。 值得一提的是 , 这项研究首次提出新冠病毒S蛋白结合ACE2的亲和力要远高于SARS-CoV的S蛋白 。 早在1月21日和1月23日 , 中科院上海巴斯德研究所研究员郝沛等人、中科院武汉病毒所研究院石正丽等人均发表论文提到 , 新型冠状病毒和SARS病毒一样 , 也是通过利用S蛋白结合人体ACE2蛋白进入细胞 。 不过 , 病毒与宿主细胞作用的关键S蛋白有更大的差异性 。 郝沛等人还利用分子结构模拟的计算方法 , 评估了新型冠状病毒和SARS病毒的S蛋白与人类ACE2分子相互作用的能力 。 结果发现 , 虽然新型冠状病毒的S蛋白与ACE2之间的作用力低于SARS病毒 , 但是仍然非常强大 。 “尽管新型冠状病毒的新结构与ACE2蛋白互作能力 , 由于丢失的少数氢键有所下降(相比SARS病毒S-蛋白与ACE2的作用有下降) , 但仍然达到很强的结合自由能(-50.6 kcal/mol) 。 ” 而与之相关的病毒传染力目前也有众多团队给出数据 。 近日迄今为止最大规模新冠肺炎临床数据的分析认为 , 衡量疾病传染能力强弱的基本传染数R0约为3.77 , 即在没有防护措施的情况下每例患者平均会传染给另外3.77人 , 同时强于SARS病毒的R0(2.9-3.324) 。 这也是迄今为止研究团队得出的新冠病毒的最高R0值 。 值得一提的是 , 此番破解工作使用了斩获2017年诺贝尔化学奖的“冷冻电镜” 。 冷冻电子显微镜 , 就是应用冷冻固定术 , 在低温下使用透射电子显微镜观察样品的显微技术 , 让研究者能将生物分子“冻起来” , 前所未有地观察分析运动过程 。 这一表征对于生命化学的理解和药物学的发展都有决定性影响 , 使得生物化学进入一个新的时代 。 新冠病毒如何入侵人体 研究团队发现 , 新型冠状病毒利用高度糖基化的同源三聚体S蛋白进入宿主细胞 。 S蛋白经历很多种结构重新排列后将病毒融合进入宿主细胞的细胞膜 。 这一过程包括病毒的S1亚基结合到宿主细胞受体上 , 引发三聚体不稳定性的发生 , 进而造成S1亚基脱落S2亚基形成高度稳定的融合后结构 。 为了接近宿主细胞受体 , S1亚基中的受体结合结构域(RBD)会经历类似铰链的构象移动从而隐藏或者暴露受体结合的关键位点 。 在这一过程中S1存在两种状态:“向下(down)”结构代表了受体不可结合状态 , 而“向上(up)”结构则代表了受体可结合状态 , 但同时“向上”结构较为不稳定 。
推荐阅读
- 【杨力】为何我的股票被清仓了?
- 『曼谷』?新冠健康证也有假!泰国曼谷一男子网售假医疗证明被捕
- 「武汉市」关于武汉市新冠肺炎确诊病例数确诊病例死亡数订正情况的通报
- 启文随写@龙岭迷窟:雮尘珠是何物,为何能解除诅咒,谁能得到雮尘珠
- 「疫情防控」最高检发布第十批涉新冠肺炎疫情典型案例
- 新冠疫情■漠河市人民医院:防疫前沿哨 战“役”排头兵
- 「经济复苏」夜间灯光透露经济复苏迹象
- 「新冠」吃大蒜防新冠?5G会传播病毒?世卫辟谣14个传言
- 南方都市报@央企干部酒驾致人死亡,抗诉求缓为何反被加刑?
- 肺炎:四部委:对外籍新冠肺炎患者实行先救治后收费